题目内容
4.对下列说法,正确的说法是( )| A. | 放热的反应发生时不必加热,吸热反应都需要加热后才能发生 | |
| B. | 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 | |
| C. | 化学反应一定有能量变化,当△H为“-”时,表示该反应为吸热反应 | |
| D. | 已知C(s)+$\frac{1}{2}$O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol |
分析 A、有的放热反应需要高温条件,有的吸热反应无需条件就可以发生;
B、化学反应的反应热等于产物和反应物之间的能量差,只与反应体系的反应物和产物有关;
C、△H为“-”时,表示该反应为放热反应;
D、燃烧热的含义:完全燃烧1mol物质生成最稳定的氧化物所放出的能量,碳燃烧生成稳定氧化物是二氧化碳.
解答 解:A.有的放热反应需要高温条件,如铝热反应,有的吸热反应无需条件就可以发生,如氯化铵和强碱之间的反应,故A错误;
B.在化学反应中,反应的能量变化焓变和物质的聚集状态有关,和方程式的系数有关,与反应的途径无关,故B正确;
C.当△H<0时,表示该反应为放热反应,故C错误;
D.燃烧热的含义:完全燃烧1mol物质生成最稳定的氧化物所放出的能量,碳的燃烧热应该是生成二氧化碳时所放出的能量,故C错误;
故选B.
点评 本题考查反应热,注意反应热和焓变知识是热化学部分的重点,学生可以根据所学知识解答,注意平时知识的积累是关键,题目较简单.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
16.下列有关物质的表达式正确的是( )
| A. | 苯的最简式:C6H6 | B. | 乙烯分子的结构简式为:CH2CH2 | ||
| C. | 一氯甲烷的电子式为: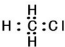 | D. | 2-甲基丁烷的键线式: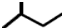 |
15.造成酸雨的主要大气污染是( )
| A. | CO2 | B. | CO | C. | SO2 | D. | Cl2 |
9.三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用. NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到.
(1)写出制备 NF3的化学反应方程式:4NH3+3F2=NF3+3NH4
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是NH3能形成氢键,NF3只有范德华力
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为1s22s22p63s23p63d54s1(或[Ar]3d54s1)
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为Na3AlF6其中心离子是Al,配位数为6.
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ•mol-1 ),回答下面各题:
①在周期表中,最可能处于同一族的是R和U.
②T元素最可能是P区元素.若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为平面正三角形,其中心原子的杂化方式为sp2.
(1)写出制备 NF3的化学反应方程式:4NH3+3F2=NF3+3NH4
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是NH3能形成氢键,NF3只有范德华力
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子排布式为1s22s22p63s23p63d54s1(或[Ar]3d54s1)
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为Na3AlF6其中心离子是Al,配位数为6.
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ•mol-1 ),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
②T元素最可能是P区元素.若T为第二周期元素,E是第三周期元素中原子半径最小的元素,则T、E形成化合物的空间构型为平面正三角形,其中心原子的杂化方式为sp2.
16.X、Y、Z、M、N是元素周期表中的短周期主族元素,且原子序数依次递增.已知X的最外层电子数是电子层数的3倍,X、N同主族,Y在同周期主族元素中原子半径最小,Z在同周期主族元素中原子半径最大.M和N可以形成MN型离子化合物.下列有关说法正确的是( )
| A. | X与Z只能形成一种化合物 | |
| B. | 最高价氧化物对应水化物的碱性:M>Z | |
| C. | 气态氢化物的热稳定性:Y>N | |
| D. | 单质的氧化性:X<N |
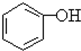 合成
合成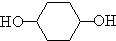
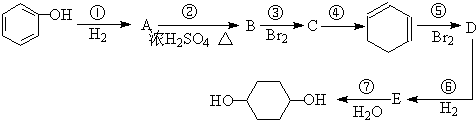
 C、
C、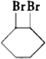
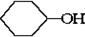 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O⑦
+H2O⑦ +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$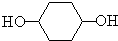 +2NaBr.
+2NaBr.
 .
. .
.
 到D的合成路线(无机试剂任选,用合成路线流程图表示).
到D的合成路线(无机试剂任选,用合成路线流程图表示).