题目内容
6.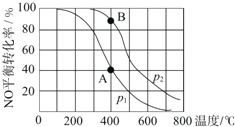 已知:2NO(g)+O2(g)?2NO2(g),其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图),下列说法不正确的是( )
已知:2NO(g)+O2(g)?2NO2(g),其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图),下列说法不正确的是( )| A. | p1<p2 | B. | 该反应的△H<0 | ||
| C. | A、B两点的平衡常数:K(A)<K(B) | D. | A、B两点的化学反应速率:v(A)<v(B) |
分析 根据图象可知,采用定一议二法,相同压强下,升高温度,NO转化率减小,说明正反应是放热反应,则△H<0;相同温度下,增大压强,平衡向正反应方向移动,则NO的转化率增大,则p1<p2;压强大,反应速率大;平衡常数K只受温度影响,A、B两点温度相同,K相同,据此解答.
解答 解:根据图象可知,采用定一议二法,相同压强下,升高温度,NO转化率减小,说明正反应是放热反应,则△H<0;相同温度下,增大压强,平衡向正反应方向移动,则NO的转化率增大,则p1<p2;压强大,反应速率大,B点压强是p2,所以v(A)<v(B);平衡常数K只受温度影响,A、B两点温度相同,K相同,故C正确,
故选C.
点评 本题考查了化学平衡影响因素分析,注意应用定一议二法分析图象,掌握基础是关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列叙述中,正确的是( )
| A. | 能使溴水褪色的物质一定能和溴水发生加成反应 | |
| B. | 天然蛋白质水解的最终产物是多种α-氨基酸 | |
| C. | 能发生银镜反应的物质都是醛 | |
| D. | 棉花和蚕丝的主要成分都是蛋白质 |
17.下列说法中,正确的是( )
| A. | H2SO4的摩尔质量是98 g | |
| B. | 1 mol CO2的体积是22.4 L | |
| C. | 0.2 mol H2O的质量是3.6 g | |
| D. | 0.1 mol/LFeCl3溶液中,C1-的物质的量浓度为0.1 mol/L |
1.NiCl2是化工合成中最重要的镍源,工业上以金属镍废料为原料生产NiCl2,继而生产Ni2O3的工艺流程如图1:
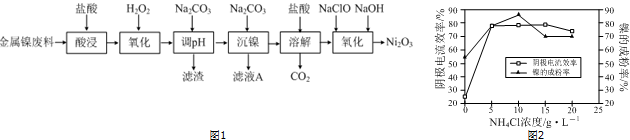
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③增大盐酸的浓度(或将镍废料研成粉末等)等.
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是氯化钠.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05~0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图2所示:
①NH4Cl的浓度最好控制为10g•L-1.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是氯化钠.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05~0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图2所示:
①NH4Cl的浓度最好控制为10g•L-1.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).
11.室温下,甲、乙两烧杯均盛有5mlpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4,关于甲、乙两烧杯中溶液的描述正确的是( )
| A. | 溶液的体积:V乙≤10V甲 | |
| B. | 若分别与5mlpH=11的NaOH溶液反应,所得溶液的pH:甲≤乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 | |
| D. | 水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 |
18.下列过程中,共价键被破坏的是( )
| A. | 木炭吸附溴蒸气 | B. | 干冰升华 | C. | 葡萄糖溶于水 | D. | 氯化氢溶于水 |
15.短周期元素V、X、Y、Z、W原子序数依次增大,其中,V为原子半径最小的原子,X与Y、Z与W的核外电子层数相同,最大层电子数依照Z,X,Y,W的顺序成公差为1的等差数列,元素X、W的原子序数之和是Y的3倍.以下说法中正确的是( )
| A. | 简单离子半径从小到大:V、Y、X、W、Z | |
| B. | X、Y、Z均只能与V形成共价化合物 | |
| C. | 气态氢化物稳定性:X<W,其中的原因是X-V键的键能小于W-V键 | |
| D. | Z与碳元素形成的一种常见化合物的分子式为ZC |
15.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有Zn+CuSO4═ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2;
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成铜锌原电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4 MgSO4 Ag2SO4 k2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是Ag2SO4;
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(1)上述实验中发生反应的化学方程式有Zn+CuSO4═ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2;
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成铜锌原电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4 MgSO4 Ag2SO4 k2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是Ag2SO4;
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 混合溶液实验 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
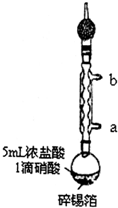 实验室制备无水二氯化锡的主要步骤如下:
实验室制备无水二氯化锡的主要步骤如下: