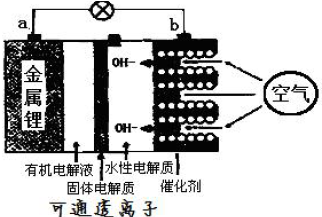
题目内容
14.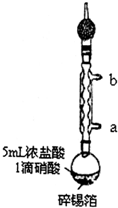 实验室制备无水二氯化锡的主要步骤如下:
实验室制备无水二氯化锡的主要步骤如下:步骤1:在圆底烧瓶中加入1.20g碎锡箔和5mL浓盐酸、1滴硝酸,实验装置如图所示.组装好后在95℃时回流0.5h,待圆底烧瓶中只剩余少量锡箔为止;
步骤2:将上述反应的上清液迅速转移到仪器X中,在二氧化碳气氛保护下,蒸发浓缩,冷却结晶,过滤得到二氯化锡晶体:
步骤3:在二氯化锡晶体中加入10mL醋酐,即可得无水二氯化锡,过滤;
步骤4:用少量乙醚冲洗三次,置于通风橱内,待乙醚全部挥发后得到无水二氯化锡.
回答下列问题:
(1)步骤1中,圆底烧瓶中发生反应的化学方程式为Sn+2HCl=SnCl2+H2↑;冷却水从接口a(填“a”或“b”)进入.实验采取的加热方式是95℃水浴加热;球形冷凝管上连接装有碱石灰的干燥管的目的是吸收HCl,防止HCl气体进入空气中.
(2)步骤2中,仪器X的名称为蒸发皿;二氧化碳气氛的作用是防止空气中的氧气氧化Sn2+.
(3)步骤3中,醋酐的作用是吸水;二氯化锡晶体在进行步骤3操作前应采取的加工措施是研碎,该加工措施需要仪器的名称是研钵.
(4)已知 SnCl2+Cl-═SnCl3-,实验中需控制浓盐酸的用量,其原因是盐酸过量时生成SnCl3-,过少时二氯化锡水解程度增大;实验室配制并保存二氯化锡溶液时,需要加入的物质是稀盐酸和Sn.
分析 (1)Sn和浓盐酸反应生成SnCl2和H2;冷凝管中的水是逆流的;温度小于100℃时采用水浴加热的方法;HCl会污染空气,所以尾气要处理;
(2)蒸发浓缩溶液的仪器是蒸发皿;Sn2+不稳定,易被空气氧化;
(3)醋酸酐能和水反应生成醋酸,则醋酸酐有吸水作用;只有二氯化锡的晶体表面积越大时,除去晶体中的水分才能越充分;研碎晶体的仪器是研钵;
(4)根据方程式知,盐酸过量时生成SnCl3-,过少时二氯化锡水解程度增大;
二氯化锡易水解且易被氧化,所以在配制二氯化锡溶液时要防止水解和氧化.
解答 解:(1)Sn和浓盐酸反应生成SnCl2和H2,反应方程式为Sn+2HCl=SnCl2+H2↑,为了充分冷却蒸气且防止温度过高的蒸气急剧冷却而炸裂冷凝管,则冷凝管中的水是逆流的,所以a是进水口、b是出水口;温度小于100℃时采用水浴加热的方法,所以该实验的条件是95℃水浴加热;HCl会污染空气,所以尾气要处理,用碱性物质吸收HCl,所以碱石灰的作用是吸收HCl,
故答案为:Sn+2HCl=SnCl2+H2↑;a;95℃水浴加热;吸收HCl,防止HCl气体进入空气中;
(2)蒸发浓缩溶液的仪器是蒸发皿;Sn2+不稳定,易被空气氧化,为防止被空气氧化,需要在二氧化碳气氛中进行,故答案为:蒸发皿;防止空气中的氧气氧化Sn2+;
(3)醋酸酐能和水反应生成醋酸,则醋酸酐有吸水作用;只有二氯化锡的晶体表面积越大时,除去晶体中的水分才能越充分,所以在操作3之前必须将其研碎;研碎晶体的仪器是研钵,
故答案为:吸水;研碎;研钵;
(4)根据方程式知,盐酸过量时生成SnCl3-,过少时二氯化锡水解程度增大,所以要控制浓盐酸的量;
二氯化锡易水解且易被氧化,所以在配制二氯化锡溶液时要防止水解和氧化,需要的物质是Sn和稀盐酸,
故答案为:盐酸过量时生成SnCl3-,过少时二氯化锡水解程度增大;稀盐酸和Sn.
点评 本题考查制备实验方案设计,为高频考点,侧重考查实验操作及实验评价能力、获取信息解答问题能力,涉及盐类水解、仪器的选取、反应条件的判断、氧化还原反应等知识点,明确实验原理及基本操作方法、规范性是解本题关键,注意冷凝水的水流方向.

(1)NH3催化还原NxOy可以消除氮氧化物的污染,包含以下反应:
反应Ⅰ:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
则△H3=△H1-3△H2(用△H1和△H2的代数式表示).n(N2)(mol)
相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
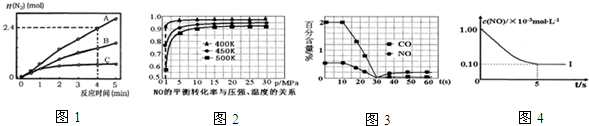
①计算0~4min在A催化剂作用下,反应速率v(NO)=0.36mol•L-1•min-1.
②下列说法不正确的是a.
a.该反应的活化能大小顺序是:Ea(A)>Eb(B)>Ec(C)
b.缩小体积能使体系压强增大,反应速率加快,但活化分子的百分数不变
c.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(2)三元催化转化装置是安装在汽车排气系统中最重要的机外净化装置,装置中涉及的反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到如图2所示的曲线.催化装置比较适合的温度和压强是400K,1MPa.
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图3所示.则前10s内,CO和NO百分含量没明显变化的原因是尚未达到催化剂工作温度(或尚未达到反应的温度).
| 实验编号 | T(K) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表面积(m2/g) |
| Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
| Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
| Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
根据坐标图4,计算400K时该反应的平衡常数为5000L•mol-1;并在图中画出上表中的实验II、III条件下混合气体中NO浓度随时间变化的趋势曲线图(标明各条曲线的实验编号).
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将光亮的镁条放入盛有NH4Cl溶液的试管中 | 有大量气泡产生 | 生成的气体是NH3 |
| B | 向AgI悬浊液中加入NaCl细粒 | 一定不出现白色沉淀 | 更难溶的物质无法转化为难溶的物质 |
| C | 某实验小组从资料上获得信息:Fe3+可以氧化银单质.他们用这种方法清洗了一批做了银镜反应的试管.配制了Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别用于清洗试管. | 用FeCl3溶液清洗比用Fe2(SO4)3溶液清洗得干净 | Fe3+氧化银单质的过程可能是一个可逆过程: Fe3++Ag?Fe2++Ag+ |
| D | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液呈红色 | 溶液中一定含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
| A. | 向浓氨水中滴加饱和FeCl3溶液,可以制得Fe(OH)3胶体 | |
| B. | 为除去Mg(OH)2固体中少量Ca(OH)2,可用饱和MgCl2溶液多次洗涤后,再水洗、干燥 | |
| C. | 向溶液X中加入足量盐酸,产生无色无味气体,将气体通入澄清石灰水,产生白色沉淀,说明溶液X中含有CO32- | |
| D. | 卤代烃Y与NaOH醇溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀,说明卤代烃Y中含有氯原子 |
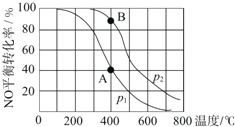 已知:2NO(g)+O2(g)?2NO2(g),其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图),下列说法不正确的是( )
已知:2NO(g)+O2(g)?2NO2(g),其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图),下列说法不正确的是( )| A. | p1<p2 | B. | 该反应的△H<0 | ||
| C. | A、B两点的平衡常数:K(A)<K(B) | D. | A、B两点的化学反应速率:v(A)<v(B) |
| A. | 60g丙醇中存在的共价键总数为11NA | |
| B. | 0.5 mol•L-1 CuCl2溶液中含有的Cl-个数为NA | |
| C. | 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA | |
| D. | 在反应4Cl2+8NaOH═6NaCl+NaClO+NaClO3+4H2O中,消耗1mol Cl2时转移的电子总数为1.5NA |
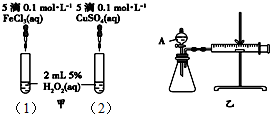 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )| A. | 实验中H2O2分解的速率为(1)>(2) | |
| B. | 图乙实验可通过测定相同状况下,产生的气体体积与反应时间来比较反应速率 | |
| C. | H2O2分解的热化学方程式2H2O2(l)═2H2O(l)+O2(g)△H>0 | |
| D. | 图甲中(1)、(2)两个实验中H2O2分解的△H相同 |
 .
.