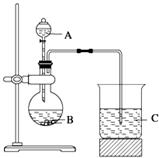
题目内容
15.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:(1)上述实验中发生反应的化学方程式有Zn+CuSO4═ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2;
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成铜锌原电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4 MgSO4 Ag2SO4 k2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是Ag2SO4;
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 混合溶液实验 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
分析 (1)锌较活泼,可与硫酸铜、硫酸等发生置换反应;
(2)硫酸铜溶液加快氢气生成的速率,原因是形成原电池反应;
(3)如形成原电池反应,所加硫酸盐对应的金属应比锌的活泼性弱;
(4)结合浓度、温度、催化剂等因素对反应速率的影响分析;
(5)①为保证实验有对比性,只能逐渐改变一个变量分析,CuSO4溶液体积逐渐增多,故H2SO4的量应相等均为30mL,水的量减小,但每组实验中CuSO4与水的体积之和应相等;
②Zn与CuSO4溶液生成Cu会附着在锌的表面.
解答 解:(1)因为Cu2+的氧化性比H+的强,所以加入硫酸铜,Zn先跟硫酸铜反应,反应完后再与酸反应,反应的有关方程式为Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑,
故答案为:Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)锌为活泼金属,加入硫酸铜,发生Zn+CuSO4=ZnSO4+Cu,置换出铜,与锌形成原电池反应,化学反应速率加快,
故答案为:CuSO4与Zn反应产生的Cu与Zn形成铜锌原电池,加快了氢气产生的速率;
(3)Na2SO4 MgSO4 Ag2SO4 k2SO4等4种溶液中,能与锌发生置换反应且能形成原电池反应的只有Ag2SO4,
故答案为:Ag2SO4;
(4)对于溶液中的化学反应,影响反应速率的因素还有浓度、温度、催化剂以及固体表面积大小等,要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的表面积等,
故答案为:升温,增加H2SO4浓度;
(5)①要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同.A组中硫酸为30ml,那么其它组硫酸量也都为30ml.而硫酸铜溶液和水的总量应相同,F组中硫酸铜20ml,水为0,那么总量为20ml,所以V2=10ml,V3=17.5ml,V1=30ml.
故答案为:30;10;17.5;
②当加入一定量的硫酸铜后,Zn与CuSO4溶液生成Cu会附着在锌的表面,降低了锌与溶液的接触面积,所以反应速率会降低;
故答案为:当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
点评 本题考查了影响化学反应速率的因素、化学实验探究,题目难度中等,注意把握影响速率的因素,本题的易错点在于第(5)小题,首先V1、V2、V3的求得要注意分析表中数据,侧重于考查学生的实验探究能力.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案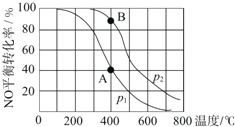 已知:2NO(g)+O2(g)?2NO2(g),其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图),下列说法不正确的是( )
已知:2NO(g)+O2(g)?2NO2(g),其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图),下列说法不正确的是( )| A. | p1<p2 | B. | 该反应的△H<0 | ||
| C. | A、B两点的平衡常数:K(A)<K(B) | D. | A、B两点的化学反应速率:v(A)<v(B) |
| A. | 黑色金属材料通常包括铁、铬、铜以及它们的合金,是应用非常广泛的金属材料 | |
| B. | 烹鱼时加入少量的料酒和食醋可减少腥味,增加香味,属于物理变化 | |
| C. | 若分散质粒子直径在1nm-100nm之间,则其为胶体;放电时放映室射到银幕上的光柱的形成属于丁达尔效应 | |
| D. | Na2CO3•10H2O在干燥空气中失水和木材干馏制焦炭都属于化学变化 |
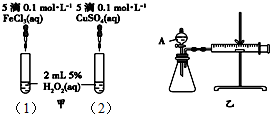 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )| A. | 实验中H2O2分解的速率为(1)>(2) | |
| B. | 图乙实验可通过测定相同状况下,产生的气体体积与反应时间来比较反应速率 | |
| C. | H2O2分解的热化学方程式2H2O2(l)═2H2O(l)+O2(g)△H>0 | |
| D. | 图甲中(1)、(2)两个实验中H2O2分解的△H相同 |
(1)上述实验中发生反应的离子方程式有Zn+Cu2+═Zn2++Cu,Zn+2H+═Zn2++H2↑;
(2)实验室中现有Na2SO4、MgSO4、FeSO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是FeSO4;
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如表一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
Ⅱ、某兴趣组进行下列实验测定某稀硫酸的质量分数,选用酚酞做指示剂.
操作①:取5.00mL稀H2SO4溶液(密度为1.00g/mL)置于锥形瓶中加水稀释;
操作②:用0.1000mol/LKOH标准溶液滴定;
操作③:用同样方法滴定,4次消耗KOH溶液的体积分别为20.00mL、19.98mL、20.02mL、20.40mL.
请回答下列问题:
(4)如何判定滴定终点:当滴入最后一滴KOH标准溶液后,溶液由无色变成浅红色,且半分钟内不再恢复原来的颜色.
(5)在上述实验中,下列操作会造成测定结果偏高的有AD(填序号).
A.锥形瓶用待测液润洗
B.量取稀H2SO4溶液的滴定管用蒸馏水洗净,未用稀H2SO4溶液润洗
C.滴定速度过快,又未摇匀,停止滴定后发现红色褪去
D.滴定前读数时平视,滴定终点读数时仰视
(6)分析数据,计算稀H2SO4溶液中溶质的质量分数为1.96%(保留三位有效数字).
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
②铝无论与1.5mol/L硫酸还是3.0mol/L硫酸进行反应,与盐酸相比都无明显现象,根据以上铝与稀盐酸和稀硫酸反应差异,有人做出了一种假设或者猜想
假设或猜想一:Cl-能促进金属铝与H+的反应
假设或猜想二:SO42-对H+与金属铝的反应起阻碍作用
请将上述猜想补充完整,并验证.除上述试剂外,还有下列试剂可以选择:单质Mg、Na2SO4固体、NaCl固体、硝酸将上述没有明显反应的溶液中加入少量的NaCl固体,如果产生气泡,说明假设一成立
(2)试用简单的一种实验证明,在醋酸溶液中存在着:CH3COOH?H++CH3COO-的电离平衡.限制选试剂和用品:PH试纸、PH=2的醋酸溶液、醋酸钠固体、蒸馏水,仪器任选.写出简要操作、现象.(结论已经给你写好)将pH=2的溶液稀释100后,再测定其pH,若pH小于4,说明醋酸溶液中存在电离平衡说明醋酸溶液中存在电离平衡.
| A. | 4 | B. | 7 | C. | 8 | D. | 11 |
| A. | 20种 | B. | 29种 | C. | 30种 | D. | 48种 |