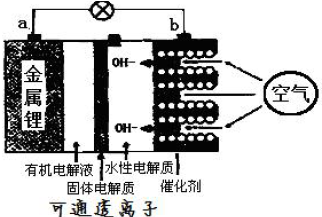
题目内容
1.NiCl2是化工合成中最重要的镍源,工业上以金属镍废料为原料生产NiCl2,继而生产Ni2O3的工艺流程如图1: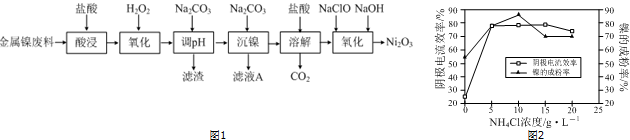
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是氯化钠.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05~0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图2所示:
①NH4Cl的浓度最好控制为10g•L-1.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).
分析 流程分析,镍废料用盐酸酸浸后得酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等,加入过氧化氢氧化亚铁离子为铁离子,加入碳酸钠溶液调节溶液的PH,使铝离子、铁离子全部沉淀,过滤后的滤液中再加入碳酸钠沉淀镍离子得NiCO3,滤液A中含有NaCl等物质,将NiCO3再溶于盐酸,得氯化镍溶液,向其中加入次氯酸钠和氢氧化钠溶液可得Ni2O3,
(1)为了提高金属镍废料浸出的速率,可以从提高温度、酸的浓度、充分搅拌,研磨废料增大接触面积等影响反应速率的因素分析;
(2)沉镍前要将铝离子和铁离子沉淀完全,而镍离子不能产生沉淀,据此判断;
(3)滤液A中主要含有氯化钠,可回收利用;
(4)Cl由+1价降低到-1价,Ni由+2价升高到+3价,利用化合价升降相等可配平ClO-、Ni(OH)2、Cl-、Ni2O3的系数,据此书写离子方程式;
(5)①根据图2可知,NH4Cl的浓度为10g•L-1时,镍的成粉率最高;
②当NH4Cl浓度大于15g•L-1时,阴极有氢气生成,导致阴极电流效率降低,据此书写电极反应式;
解答 解:流程分析,镍废料用盐酸酸浸后得酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等,加入过氧化氢氧化亚铁离子为铁离子,加入碳酸钠溶液调节溶液的PH,使铝离子、铁离子全部沉淀,过滤后的滤液中再加入碳酸钠沉淀镍离子得NiCO3,滤液A中含有NaCl等物质,将NiCO3再溶于盐酸,得氯化镍溶液,向其中加入次氯酸钠和氢氧化钠溶液可得Ni2O3,
(1)为了提高金属镍废料浸出的速率,可采取的措施有:①适当升高温度;②搅拌;③增大盐酸的浓度(或将镍废料研成粉末等)等,
故答案为:增大盐酸的浓度(或将镍废料研成粉末等);
(2)沉镍前要将铝离子和铁离子沉淀完全,而镍离子不能产生沉淀,所以溶液的PH值控制在4.7~7.1,
故答案为:4.7~7.1;
(3)滤液A中主要含有氯化钠,可回收利用,
故答案为:氯化钠;
(4)Cl由+1价降低到-1价,Ni由+2价升高到+3价,利用化合价升降相等可配平ClO-、Ni(OH)2、Cl-、Ni2O3的系数,反应的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O,
故答案为:2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O;
(5)①根据图2可知,NH4Cl的浓度为10g•L-1时,镍的成粉率最高,所以NH4Cl的浓度最好控制为10 g•L-1,
故答案为:10 g•L-1;
②当NH4Cl浓度大于15g•L-1时,阴极有氢气生成,导致阴极电流效率降低,电极反应式为2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O),
故答案为:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).
点评 本题考查了流程分析推断,实验操作步骤的分析判断,化学方程式计算和电解原理分析应用,题目综合性较大,难度较大.

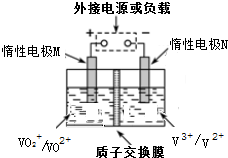 全钒液流储能电池是以溶解于一定浓度硫酸溶液中不同价态钒离子的氧化还原反应来实现化学能和电能相互转化,充电时,惰性电极M、N分别连接电源的正极和负极.电池工作原理如图所示,下列说法不正确的是( )
全钒液流储能电池是以溶解于一定浓度硫酸溶液中不同价态钒离子的氧化还原反应来实现化学能和电能相互转化,充电时,惰性电极M、N分别连接电源的正极和负极.电池工作原理如图所示,下列说法不正确的是( )| A. | 放电过程中,M电极反应为V02++2H++e一=V02++H20 | |
| B. | 放电过程中,质子通过交换膜从负极区移向正极区 | |
| C. | 充电过程中,N电极上V3+被还原为V2+ | |
| D. | 充电过程中,M电极附近酸性减弱 |
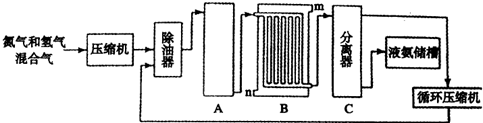
请回答下列问题.
(1)设备A中含有电加热器,触媒和热交换器,其中发生的化学反应方程式为N2+3H2
 2NH3,设备A的名称是合成塔;
2NH3,设备A的名称是合成塔;(2)设备B中m和n是两个通水口,入水口是n(填“m”或“n”);不宜从相反方向通水的原因是高温气体从冷却塔的上端进入,冷却水应从下端进入,逆向冷却效果好.
(3)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是液化,分馏.
(4)天然气、重油、煤都可以与水反应制得氢气.下表是某合成氨厂采用不同原料的相对投资和能量消耗.
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J•t-1 | 28109 | 38109 | 48109 |
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:CH4+H2O$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$CO+3H2.
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g)△H=-394kJ/mol
2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式C(S)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g) △H=+131KJ/mol.
(5)在合成氨生产中,将生成的氨及时从反应后的气体中分离出来.运用化学平衡的知识分析这样做的理由:移走氨气,减小生成物浓度,平衡右移,有利于氨合成.
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
(1)反应温度控制在30-35℃,是因为高于35℃NH4HCO3会分解,低于,30℃则反应速率降低,为控制此温度范围,通常采取的加热方法为水浴加热.
(2)加料完毕,保温30min,目的使反应充分进行.
(3)静置后只析出NaHCO3晶体的原因NaHCO3的溶解度最小.
(4)过滤所得母液中含有NaHCO3、NaCl、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使NaCl(填化学式)循环使用,回收得到NH4Cl晶体.
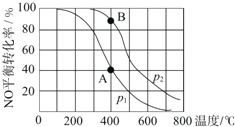 已知:2NO(g)+O2(g)?2NO2(g),其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图),下列说法不正确的是( )
已知:2NO(g)+O2(g)?2NO2(g),其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图),下列说法不正确的是( )| A. | p1<p2 | B. | 该反应的△H<0 | ||
| C. | A、B两点的平衡常数:K(A)<K(B) | D. | A、B两点的化学反应速率:v(A)<v(B) |
(1)上述实验中发生反应的离子方程式有Zn+Cu2+═Zn2++Cu,Zn+2H+═Zn2++H2↑;
(2)实验室中现有Na2SO4、MgSO4、FeSO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是FeSO4;
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如表一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
Ⅱ、某兴趣组进行下列实验测定某稀硫酸的质量分数,选用酚酞做指示剂.
操作①:取5.00mL稀H2SO4溶液(密度为1.00g/mL)置于锥形瓶中加水稀释;
操作②:用0.1000mol/LKOH标准溶液滴定;
操作③:用同样方法滴定,4次消耗KOH溶液的体积分别为20.00mL、19.98mL、20.02mL、20.40mL.
请回答下列问题:
(4)如何判定滴定终点:当滴入最后一滴KOH标准溶液后,溶液由无色变成浅红色,且半分钟内不再恢复原来的颜色.
(5)在上述实验中,下列操作会造成测定结果偏高的有AD(填序号).
A.锥形瓶用待测液润洗
B.量取稀H2SO4溶液的滴定管用蒸馏水洗净,未用稀H2SO4溶液润洗
C.滴定速度过快,又未摇匀,停止滴定后发现红色褪去
D.滴定前读数时平视,滴定终点读数时仰视
(6)分析数据,计算稀H2SO4溶液中溶质的质量分数为1.96%(保留三位有效数字).