题目内容
17.下列说法中,正确的是( )| A. | H2SO4的摩尔质量是98 g | |
| B. | 1 mol CO2的体积是22.4 L | |
| C. | 0.2 mol H2O的质量是3.6 g | |
| D. | 0.1 mol/LFeCl3溶液中,C1-的物质的量浓度为0.1 mol/L |
分析 A.摩尔质量是以g/mol为单位数值上等于其相对分子质量;
B.标准状况下1mol气体的摩尔体积为22.4L;
C.依据n=$\frac{m}{M}$计算分析;
D.离子浓度=溶质浓度×离子数.
解答 解:A.摩尔质量是以g/mol为单位数值上等于其相对分子质量,H2SO4的摩尔质量是98 g/mol,故A错误;
B.标准状况下1mol气体的摩尔体积为22.4L,温度压强不知1 mol CO2的体积不一定是22.4L,故B错误;
C.结合n=$\frac{m}{M}$计算,0.2 mol H2O的质量=0.2mol×18g/mol=3.6 g,故C正确;
D.离子浓度=溶质浓度×离子数,0.1 mol/LFeCl3溶液中,C1-的物质的量浓度为0.3 mol/L,故D错误;
故选C.
点评 本题考查了摩尔质量概念和计算、离子浓度、气体摩尔体积的一样条件,题目较简单.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
7.关于如图各装置的叙述中,正确的是( )


| A. | 装置①可用于分离I2与NH4Cl混合物 | |
| B. | 装置②收集并测量Cu与浓硫酸反应产生的气体的体积 | |
| C. | 装置③制取氯气 | |
| D. | 装置④制取无水MgCl2 |
8.分析如表中各项的排布规律,有机物X是按此规律排布的第20项,下列有关X的组成、性质的说法中肯定错误的是( )
①是戊酸、②是戊醇、③是乙酸丙酯、④一定能发生酯化反应、⑤一定能与钠反应.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH4O | CH2O | CH2O2 | C2H6 | C2H6O | C2H4O | C2H4O2 |
| A. | ①③④ | B. | ②④⑤ | C. | ②③④ | D. | ②③⑤ |
5.下列有关实验的操作、现象及结论解析都没有科学性错误的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将光亮的镁条放入盛有NH4Cl溶液的试管中 | 有大量气泡产生 | 生成的气体是NH3 |
| B | 向AgI悬浊液中加入NaCl细粒 | 一定不出现白色沉淀 | 更难溶的物质无法转化为难溶的物质 |
| C | 某实验小组从资料上获得信息:Fe3+可以氧化银单质.他们用这种方法清洗了一批做了银镜反应的试管.配制了Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别用于清洗试管. | 用FeCl3溶液清洗比用Fe2(SO4)3溶液清洗得干净 | Fe3+氧化银单质的过程可能是一个可逆过程: Fe3++Ag?Fe2++Ag+ |
| D | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液呈红色 | 溶液中一定含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
12.合成氨的流程示意图如下.
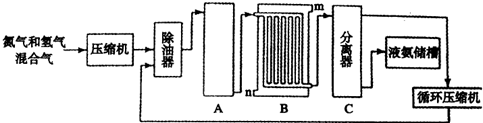
请回答下列问题.
(1)设备A中含有电加热器,触媒和热交换器,其中发生的化学反应方程式为N2+3H2 2NH3,设备A的名称是合成塔;
2NH3,设备A的名称是合成塔;
(2)设备B中m和n是两个通水口,入水口是n(填“m”或“n”);不宜从相反方向通水的原因是高温气体从冷却塔的上端进入,冷却水应从下端进入,逆向冷却效果好.
(3)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是液化,分馏.
(4)天然气、重油、煤都可以与水反应制得氢气.下表是某合成氨厂采用不同原料的相对投资和能量消耗.
①依据上表信息,你认为采用天然气为原料最好.
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:CH4+H2O$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$CO+3H2.
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g)△H=-394kJ/mol
2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式C(S)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g) △H=+131KJ/mol.
(5)在合成氨生产中,将生成的氨及时从反应后的气体中分离出来.运用化学平衡的知识分析这样做的理由:移走氨气,减小生成物浓度,平衡右移,有利于氨合成.

请回答下列问题.
(1)设备A中含有电加热器,触媒和热交换器,其中发生的化学反应方程式为N2+3H2
 2NH3,设备A的名称是合成塔;
2NH3,设备A的名称是合成塔;(2)设备B中m和n是两个通水口,入水口是n(填“m”或“n”);不宜从相反方向通水的原因是高温气体从冷却塔的上端进入,冷却水应从下端进入,逆向冷却效果好.
(3)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是液化,分馏.
(4)天然气、重油、煤都可以与水反应制得氢气.下表是某合成氨厂采用不同原料的相对投资和能量消耗.
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J•t-1 | 28109 | 38109 | 48109 |
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:CH4+H2O$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$CO+3H2.
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g)△H=-394kJ/mol
2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式C(S)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g) △H=+131KJ/mol.
(5)在合成氨生产中,将生成的氨及时从反应后的气体中分离出来.运用化学平衡的知识分析这样做的理由:移走氨气,减小生成物浓度,平衡右移,有利于氨合成.
6.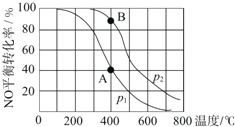 已知:2NO(g)+O2(g)?2NO2(g),其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图),下列说法不正确的是( )
已知:2NO(g)+O2(g)?2NO2(g),其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图),下列说法不正确的是( )
 已知:2NO(g)+O2(g)?2NO2(g),其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图),下列说法不正确的是( )
已知:2NO(g)+O2(g)?2NO2(g),其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图),下列说法不正确的是( )| A. | p1<p2 | B. | 该反应的△H<0 | ||
| C. | A、B两点的平衡常数:K(A)<K(B) | D. | A、B两点的化学反应速率:v(A)<v(B) |
7.化学与科学、技术、社会、环境密切相关,下列有关说法中正确的有( )
| A. | 黑色金属材料通常包括铁、铬、铜以及它们的合金,是应用非常广泛的金属材料 | |
| B. | 烹鱼时加入少量的料酒和食醋可减少腥味,增加香味,属于物理变化 | |
| C. | 若分散质粒子直径在1nm-100nm之间,则其为胶体;放电时放映室射到银幕上的光柱的形成属于丁达尔效应 | |
| D. | Na2CO3•10H2O在干燥空气中失水和木材干馏制焦炭都属于化学变化 |
 .
.