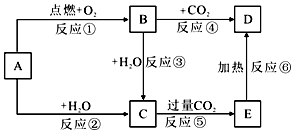
题目内容
13.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 0.2 mol NaOH含有0.2NA个NaOH分子 | |
| B. | 3.2 g O2和O3的混合气体中氧原子数为0.25NA | |
| C. | 常温下,1 mol Cl2与过量NaOH溶液反应,转移电子总数为NA | |
| D. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.1NA |
分析 A.氢氧化钠为离子晶体;
B.氧气与臭氧都是由氧原子构成,依据n=$\frac{m}{M}$×NA计算;
C.氯气与氢氧化钠反应为歧化反应,氯气既是氧化剂又是还原剂;
D.过氧化钠与水反应为歧化反应,过氧化钠既是氧化剂又是还原剂.
解答 解:A.氢氧化钠为离子晶体,不含分子,故A错误;
B.3.2 g O2和O3的混合气体中氧原子数为$\frac{3.2g}{16g/mol}×$NA=0.2NA,故B错误;
C.氯气与氢氧化钠反应为歧化反应,氯气既是氧化剂又是还原剂,1mol氯气反应转移1mol电子,转移电子总数为NA,故C正确;
D.过氧化钠与水反应为歧化反应,过氧化钠既是氧化剂又是还原剂,生成1mol氧气转移2mol电子,则生成0.1 mol氧气转移的电子数为0.2NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意歧化反应中电子数目计算.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
3.化学与生产、生活、科技等密切相关,下列说法不正确的是( )
| A. | 加大清洁能源的开发利用,提髙资源的利用率 | |
| B. | 研发使用高效催化剂,可提高反应中原料的转化率 | |
| C. | 用K2FeO4取代Cl2处理饮用水,可杀菌消毒,还能沉降水中的悬浮物 | |
| D. | 用沼气、太阳能、风能等新型能源代替化石燃料 |
4.下列实验现象描述正确的是( )
| A. | 红热的铜丝在硫蒸汽中燃烧,产生黑色固体 | |
| B. | 碘水中加入少量CCl4,振荡静置后,下层颜色变浅,上层颜色变为紫色 | |
| C. | 往溴水中加入碘化钠溶液,溴水变为无色 | |
| D. | 氢气在Cl2中燃烧产生白色的烟 |
1.加入Al能产生H2的溶液中一定能大量共存的是( )
| A. | K+、Na+、Br-、SO42- | B. | Na+、Ba2+、ClO-、Cl- | ||
| C. | Ca2+、Cl-、HCO3-、K+ | D. | NH4+、K+、OH-、SO42- |
8.a g 下列物质在氧气中充分燃烧后的气体(1.01×105 Pa,120℃),通过足量的过氧化钠充分反应后,过氧化钠增a g,则该物质为( )
| A. | CH3COOCH2CH3 | B. | HCOOH | C. | HOOCCOOH | D. | HCHO |
18.为了提纯下表所列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是( )
| 编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 乙烷(乙烯) | 溴的四氯化碳溶液 | 洗气 |
| B | 硝基苯(硝酸) | H2O | 过滤 |
| C | 溴苯(溴) | NaOH溶液 | 分液 |
| D | 乙烯(SO2) | NaOH溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
2.用下列装置不能达到有关实验目的是( )
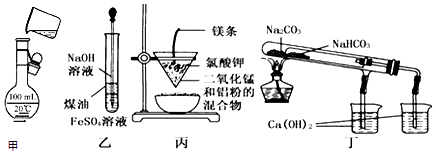

| A. | 用甲图所示装置将溶液定容到100 mL | |
| B. | 用乙图装置制备Fe(OH)2 | |
| C. | 用丙图装置可制得金属锰 | |
| D. | 用丁图装置验证NaHCO3和Na2CO3的热稳定性 |
3.下列气体既可以用浓硫酸干燥,也可以用碱石灰干燥的是( )
| A. | CO2 | B. | Cl2 | C. | NH3 | D. | H2 |