题目内容
8.关于Na2CO3溶液,下列关系不正确的是( )| A. | c(Na+)>2c(CO32-) | B. | c(Na+)=2 | ||
| C. | c(Na+)>c(CO32-)>c(OH-)>c(H+) | D. | c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
分析 在碳酸钠溶液中,物质的行为如下:Na2CO3=2Na++CO32-;
CO32-+H2O?HCO3-+OH-;
HCO3-+H2O?H2CO3+OH-;
H2O?H++OH-;
据此分析.
解答 解:A、CO32-在溶液中会水解,故溶液中的c(Na+)>2c(CO32-),故A正确;
B、由于碳酸钠溶液的浓度不明确,故钠离子的浓度不明确,故B错误;
C、CO32-在溶液中会水解,故溶液中的c(Na+)>2c(CO32-),而碳酸钠溶液是强碱弱酸盐溶液,溶液显碱性,故有c(OH-)>c(H+),则有c(Na+)>c(CO32-)>c(OH-)>c(H+),故C正确;
D、根据溶液中的电荷守恒可知c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D错误.
故选BD.
点评 本题考查了盐溶液中离子浓度的大小比较,难度不大,应注意的是电荷守恒、质子守恒和物料守恒的应用.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
18.A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如图所示.A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素.下列说法错误的是( )
| B | C |
| D |
| A. | 简单离子的半径大小关系:C>E | |
| B. | D元素的气态氢化物比C元素的气态氢化物稳定 | |
| C. | 由A、B、C三种元素组成的离子化合物中,阴、阳离子个数比为1:1 | |
| D. | 由C、D、E三种元素组成的化合物只有一种 |
19.下列化学用语的理解或表示正确的为( )
①CSO的电子式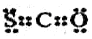
②次氯酸结构简式:H-Cl-0
③离子结构示意图: ,可以表示35Cl-,也可以表示37Cl-
,可以表示35Cl-,也可以表示37Cl-
④比例模型: 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子
⑤对硝基苯酚的结构简式
⑥葡萄糖的实验式:CH2O.
①CSO的电子式
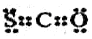
②次氯酸结构简式:H-Cl-0
③离子结构示意图:
 ,可以表示35Cl-,也可以表示37Cl-
,可以表示35Cl-,也可以表示37Cl-④比例模型:
 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子⑤对硝基苯酚的结构简式

⑥葡萄糖的实验式:CH2O.
| A. | ①③⑥ | B. | ②③④⑥ | C. | ①②④⑥ | D. | 全部正确 |
3.工业上制取硫酸铜不是直接用浓硫酸与铜反应,而是将铜丝浸入稀硫酸中并不断地从容器下部吹入细小的空气泡,这样做的优点是( )
①节省能源 ②不产生污染大气的SO2 ③提高了H2SO4的利用率 ④提高了Cu的利用率.
①节省能源 ②不产生污染大气的SO2 ③提高了H2SO4的利用率 ④提高了Cu的利用率.
| A. | ①② | B. | ③④ | C. | ①②③ | D. | 全部 |
13.某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯.

已知:
(1)制备粗品:将12.5mL环乙醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环乙烯粗品.
①A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是防止环己烯挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层,分液后用c(填入编号)洗涤.
a.KMnO4溶液 b.稀硫酸 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,冷却水从g口进入.
③收集产品时,控制的温度应在83℃左右.

已知:

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
①A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是防止环己烯挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层,分液后用c(填入编号)洗涤.
a.KMnO4溶液 b.稀硫酸 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,冷却水从g口进入.
③收集产品时,控制的温度应在83℃左右.
20.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L水中含有的分子数是NA个 | |
| B. | 32g氧气中含有的分子数为NA | |
| C. | 1mol氯气与足量的氢氧化钠溶液反应,转移的电子数为2NA | |
| D. | 1L1mol/LCaCl2溶液中含有的氯离子数为NA |
18.某同学用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等).下列分析推理正确的是( )
| 盐酸 | 50mL | 50mL | 50mL |
| m(混合物) | 9.2g | 14.2g | 27.6g |
| V(CO2)(标准状况) | 2.2L | 3.36L | 3.36L |
| A. | 混合物中NaHCO3、KHCO的物质的量之比为1:2 | |
| B. | 当混合物质量为14.2g时,50mL盐酸恰好完全反应 | |
| C. | 盐酸的物质的量浓度为3.0mol/L | |
| D. | 9.2g混合物加热,固体质量减少2.2g |
 ,则该分子中含有碳碳三键的数目为( )
,则该分子中含有碳碳三键的数目为( )