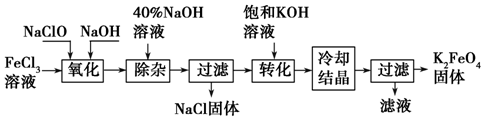
题目内容
10.下列叙述正确的是( )| A. | 非金属原子间以共价键结合的物质一定是共价化合物 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | 凡是能电离出离子的化合物一定是离子化合物 | |
| D. | 凡是含有离子键的化合物一定是离子化合物 |
分析 A.非金属原子间以共价键结合的物质可能是单质;
B.含有共价键的化合物可能是离子化合物;
C.能电离出离子的化合物可能是共价化合物;
D.含有离子键的化合物一定的离子化合物.
解答 解:A.非金属原子间以共价键结合的物质可能是单质,如氧气、氮气等,故A错误;
B.含有共价键的化合物可能是离子化合物,如氨气等,故B错误;
C.能电离出离子的化合物可能是共价化合物,如NaOH等,故C错误;
D.含有离子键的化合物一定的离子化合物,离子化合物一定含有离子键,可能含有共价键,故D正确;
故选D.
点评 本题考查化学键和物质的关系,为高频考点,侧重考查学生对基本概念的理解和掌握,明确化学键与物质关系是解本题关键,不能根据是否含有金属元素判断离子化合物,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 常温常压下,2.24 LSO2中所含氧原子数为0.2NA | |
| B. | 将1 mol Cl2通入水中,HC1O、Cl-、ClO-粒子数之和为2NA | |
| C. | 1 mol NO2与足量H2O反应,转移的电子数为NA | |
| D. | 0.1 mol熔融的NaHSO4中阳离子数目为0.lNA |
1.氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用.
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方较化石燃料和氢燃料有着较大的优势.氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2 (g)=4NO (g)+6H2O (L)△H1
②4NH3(g)+6NO(g)=5N2 (g)+6H2O (L)△H2
则反应 4NH3(g)+3O2(g)=2N2 (g)+6H2O (L)△H=$\frac{3△{H}_{1}+2△{H}_{2}}{5}$(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3L的恒容密闭容器中,投入4mol N2和9mol N2 在一定条件下合成氮,平衡时仅改变温度测得的数据如下表所示:
已知:破坏1mol N2(g)和3mol H2(g)中的化学键消耗的总能量小于破坏2mol NH3(g)中的化学键消耗的能量.
①则 T1、<T2(填“>”、“<”或“=”)
②T2K下,经过10min达到化学平衡状态,则o~10min内H2的平均速率v(H2)=0.1mol•L-1•min-1.
③下列图象分别代表焓变(△H),混合气体平均相对分子质量($\overline{M}$)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态是BC.

(3)电化学降解治理水中硝酸盐污染,在酸性条件下,电化学降解NO3-的原理如图1,阴极反应式为2NO3-+12H++10e-=N2↑+6H2O.

(4)通过控制溶液的pH对工业废水中的金属离子进行分离.图2是某些金属氢氧化物在不同浓度和pH的沉淀--溶解图象,图中直线上的点表示平衡状态.当溶液中的离子浓度小于1×10-5mol•L-1时,认为该离子沉淀完全.
由图可知Cu(OH)2的浓度积的值为1×10-21.8.
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方较化石燃料和氢燃料有着较大的优势.氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2 (g)=4NO (g)+6H2O (L)△H1
②4NH3(g)+6NO(g)=5N2 (g)+6H2O (L)△H2
则反应 4NH3(g)+3O2(g)=2N2 (g)+6H2O (L)△H=$\frac{3△{H}_{1}+2△{H}_{2}}{5}$(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3L的恒容密闭容器中,投入4mol N2和9mol N2 在一定条件下合成氮,平衡时仅改变温度测得的数据如下表所示:
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
①则 T1、<T2(填“>”、“<”或“=”)
②T2K下,经过10min达到化学平衡状态,则o~10min内H2的平均速率v(H2)=0.1mol•L-1•min-1.
③下列图象分别代表焓变(△H),混合气体平均相对分子质量($\overline{M}$)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态是BC.

(3)电化学降解治理水中硝酸盐污染,在酸性条件下,电化学降解NO3-的原理如图1,阴极反应式为2NO3-+12H++10e-=N2↑+6H2O.

(4)通过控制溶液的pH对工业废水中的金属离子进行分离.图2是某些金属氢氧化物在不同浓度和pH的沉淀--溶解图象,图中直线上的点表示平衡状态.当溶液中的离子浓度小于1×10-5mol•L-1时,认为该离子沉淀完全.
由图可知Cu(OH)2的浓度积的值为1×10-21.8.
18.A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如图所示.A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素.下列说法错误的是( )
| B | C |
| D |
| A. | 简单离子的半径大小关系:C>E | |
| B. | D元素的气态氢化物比C元素的气态氢化物稳定 | |
| C. | 由A、B、C三种元素组成的离子化合物中,阴、阳离子个数比为1:1 | |
| D. | 由C、D、E三种元素组成的化合物只有一种 |
19.下列化学用语的理解或表示正确的为( )
①CSO的电子式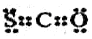
②次氯酸结构简式:H-Cl-0
③离子结构示意图: ,可以表示35Cl-,也可以表示37Cl-
,可以表示35Cl-,也可以表示37Cl-
④比例模型: 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子
⑤对硝基苯酚的结构简式
⑥葡萄糖的实验式:CH2O.
①CSO的电子式
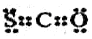
②次氯酸结构简式:H-Cl-0
③离子结构示意图:
 ,可以表示35Cl-,也可以表示37Cl-
,可以表示35Cl-,也可以表示37Cl-④比例模型:
 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子⑤对硝基苯酚的结构简式

⑥葡萄糖的实验式:CH2O.
| A. | ①③⑥ | B. | ②③④⑥ | C. | ①②④⑥ | D. | 全部正确 |
20.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L水中含有的分子数是NA个 | |
| B. | 32g氧气中含有的分子数为NA | |
| C. | 1mol氯气与足量的氢氧化钠溶液反应,转移的电子数为2NA | |
| D. | 1L1mol/LCaCl2溶液中含有的氯离子数为NA |
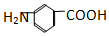 和
和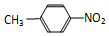 C、12C60和石墨 D、乙醇和乙二醇 E、35Cl和37Cl
C、12C60和石墨 D、乙醇和乙二醇 E、35Cl和37Cl