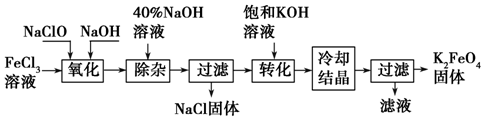
题目内容
7.根据表提供的数据可知,在溶液中能大量共存的微粒组是( )| 化学式 | 电离常数 |
| CH3COOH | K=1.7×10-5 |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | H2CO3、HCO3-、CH3COO-、CN- | B. | HCO3-、CH3COOH、CN-、CO32- | ||
| C. | HCN、HCO3-、CN-、CO32- | D. | HCN、HCO3-、CH3COO-、CN- |
分析 电离平衡常数越大酸性越强,根据电离平衡常数可知,酸性强弱为:CH3COOH>H2CO3>HCN>HCO3-,
A.四种离子之间不反应,能够共存;
B.醋酸能够与其它三种离子发生反应;
C.HCN能够与碳酸根离子反应生成碳酸氢根离子;
D.四种离子之间不发生反应,能够共存.
解答 解:电离平衡常数越大酸性越强,根据电离平衡常数可知,酸性强弱为:CH3COOH>H2CO3>HCN>HCO3-,
A.H2CO3、HCO3-、CH3COO-、CN-之间不反应,能够大量共存,故A正确;
B.酸性CH3COOH>H2CO3>HCN>HCO3-,CH3COOH与HCO3-、CN-、CO32-发生反应,在溶液中不能大量共存,故B错误;
C.酸性HCN>HCO3-,HCN、HCO3-之间发生反应,在溶液中不能大量共存,故C错误;
D.HCN、HCO3-、CH3COO-、CN-之间不反应,在溶液中能够大量共存,故D正确;
故选AD.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度不大,正确判断酸性强弱为解答关键;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
18.A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如图所示.A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素.下列说法错误的是( )
| B | C |
| D |
| A. | 简单离子的半径大小关系:C>E | |
| B. | D元素的气态氢化物比C元素的气态氢化物稳定 | |
| C. | 由A、B、C三种元素组成的离子化合物中,阴、阳离子个数比为1:1 | |
| D. | 由C、D、E三种元素组成的化合物只有一种 |
12.下列实验现象描述不正确的是( )
| 选项 | 实验 | 现象 |
| A | 加热放在坩埚中的小钠块 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着 |
| C | 在含有酚酞的水中加入一小块钠 | 钠浮在水面上,四处游动,发出嘶嘶响声,溶液变红 |
| D | 在空气中久置的铝条放入NaOH溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| A. | A | B. | B | C. | C | D. | D |

 ,可以表示35Cl-,也可以表示37Cl-
,可以表示35Cl-,也可以表示37Cl- 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子
 ,则该分子中含有碳碳三键的数目为( )
,则该分子中含有碳碳三键的数目为( )