题目内容
12. 将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:(以下均假设反应过程中溶液体积不变).
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:(以下均假设反应过程中溶液体积不变).(1)铁片上的电极反应式为Fe-2e-=Fe2+.
(2)铜片上的电极反应式为Cu2++2e-=Cu.
(3)若2min后测得铁片和铜片之间的质量差为1.2g,计算导线中流过的电子的物质的量为0.02mol.
分析 (1)铁比铜活泼,为原电池的负极,发生氧化反应;
(2)铜为正极,为原电池的正极,铜离子在正极得电子发生还原反应;
(3)结合电极方程式解答该题.
解答 解:(1)铁比铜活泼,为原电池的负极,发生氧化反应,电极方程式为Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
(2)铜为正极,铜离子在正极得电子发生还原反应,电极方程式为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(3)设转移xmol电子,则消耗0.5xmolFe,析出0.5xmolCu,则有0.5x×(64+56)=1.2,x=0.02,故答案为:0.02.
点评 本题考查原电池知识,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握原电池的工作原理,把握电极方程式的书写.

练习册系列答案
相关题目
2.下列说法中正确的是( )
| A. | 有机物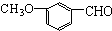 ,有多种同分异构体,其中属于酯且含有苯环结构的共有4种 ,有多种同分异构体,其中属于酯且含有苯环结构的共有4种 | |
| B. | 除去乙烯中混有的甲烷,可将混合气体通过酸性高锰酸钾溶液 | |
| C. | 甲酸分子中有醛基,因此无法区别甲醛溶液和甲酸溶液 | |
| D. | 苯乙烯分子中所有原子可能在一个平面上 |
3.某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案( )
方法Ⅰ:铜铝混合物$→_{充分反应}^{足量溶液A}$测定生成气体的体积
方法Ⅱ:铜铝混合物$→_{充分反应}^{足量B溶液}$测定剩余固体的质量.
方法Ⅰ:铜铝混合物$→_{充分反应}^{足量溶液A}$测定生成气体的体积
方法Ⅱ:铜铝混合物$→_{充分反应}^{足量B溶液}$测定剩余固体的质量.
| A. | 溶液A和溶液B均可以是盐酸或NaOH溶液 | |
| B. | 实验室中方案Ⅱ更便于实施 | |
| C. | 若溶液B选用浓硝酸,测得铜的质量分数偏大 | |
| D. | 方案一可能产生氢气,方案二可能剩余铜 |
20.下列溶液中,Cl-的物质的量浓度最小的是( )
| A. | 1 L 1 mol•L-1的NaCl溶液 | B. | 0.1 L 2 mol•L-1的KCl溶液 | ||
| C. | 0.1 L 1 mol•L-1的MgCl2溶液 | D. | 10 mL 1 mol•L-1的AlCl3溶液 |
7.以下化学用语中,正确的是( )
| A. | 乙炔分子的结构式:H-C≡C-H | B. | 苯的结构简式: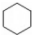 | ||
| C. | 乙醛分子的结构简式:CH3COH | D. | 甲烷分子的比例模型: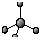 |
1.碳酸钠晶体在加热时会失去全部结晶水,而碳酸钠本身不分解.
Na2CO3•xH2O $\stackrel{加热}{→}$ Na2CO3+x H2O
现有一种碳酸钠晶体(Na2CO3•xH2O),为了测定其组成,某学生在不同温度下给试样加热(温度逐次升高),实验结果记录如下:
坩埚质量32.500g;(坩埚+晶体试样)的质量55.700g.
(1)实验取用晶体样品的质量为23.2克,完全失去结晶水后固体质量为10.6克.
(2)计算确定碳酸钠晶体(Na2CO3•xH2O )中的x值.(写出计算过程)
Na2CO3•xH2O $\stackrel{加热}{→}$ Na2CO3+x H2O
现有一种碳酸钠晶体(Na2CO3•xH2O),为了测定其组成,某学生在不同温度下给试样加热(温度逐次升高),实验结果记录如下:
坩埚质量32.500g;(坩埚+晶体试样)的质量55.700g.
| 实验次数 | 温度(℃) | 冷却后(坩埚+试样)的质量(g) |
| 1 | T1 | 48.500 |
| 2 | T2 | 44.900 |
| 3 | T3 | 43.100 |
| 4 | T4 | 43.100 |
(2)计算确定碳酸钠晶体(Na2CO3•xH2O )中的x值.(写出计算过程)
2.有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、A13+、Ba2+、Fe2+、NO3-、SO42-、Cl-、I-、HCO3-.取该溶液实验如下:
由此判断:
(1)溶液中肯定存在的离子是NO3-、SO42- Mg2+、Al3+,溶液中肯定不存在的离子是I-、Ba2+、Fe2+、HCO3-,可能存在的离子是K+、Cl-
(2)如何检验溶液中是否有可能存在的阴离子 (写明操作、现象、结论)取少量原溶液加足量的硝酸钡溶液,过滤后,向滤液中加硝酸银溶液,有白色沉淀生成,再加稀硝酸,白色沉淀不溶解,说明有Cl-,反之则没有.
| 实验步骤 | 实现现象 |
| (1)取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和 浓H2SO4,加热 | 有无色气体产生,气体遇空气中以变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子是NO3-、SO42- Mg2+、Al3+,溶液中肯定不存在的离子是I-、Ba2+、Fe2+、HCO3-,可能存在的离子是K+、Cl-
(2)如何检验溶液中是否有可能存在的阴离子 (写明操作、现象、结论)取少量原溶液加足量的硝酸钡溶液,过滤后,向滤液中加硝酸银溶液,有白色沉淀生成,再加稀硝酸,白色沉淀不溶解,说明有Cl-,反之则没有.

 .
.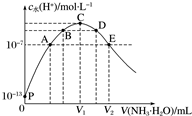 常温下向25mL盐酸中逐滴滴入0.1mol•L-1氨水,溶液中由水电离出的c水(H+)随滴入氨水的体积变化如图所示.
常温下向25mL盐酸中逐滴滴入0.1mol•L-1氨水,溶液中由水电离出的c水(H+)随滴入氨水的体积变化如图所示.