题目内容
17.A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;在适当的条件下,它们之间可发生如图所示的转化.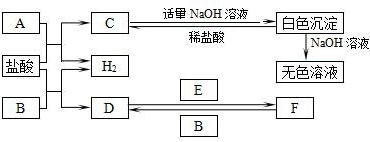
(1)A的化学式是Al
(2)反应F→D的化学方程式是2FeCl3+Fe=3FeCl2
(3)检验F中金属阳离子的常见试剂是KSCN溶液
(4)写出氢氧化钠的电子式
 .
.
分析 A、B均是常见的金属,且B的合金用量最大,则B为Fe,E在常温下是黄绿色气体,则E为Cl2,Fe与盐酸反应得到D为FeCl2,氯化亚铁与氯气反应得到F为FeCl3,金属A与盐酸反应得到C与氢气,C与NaOH反应得到白色沉淀,且白色沉淀能溶于NaOH溶液与稀盐酸,则A为Al、C为AlCl3、白色沉淀为Al(OH)3,结合对应物质的性质以及题目要求解答该题.
解答 解:A、B均是常见的金属,且B的合金用量最大,则B为Fe,E在常温下是黄绿色气体,则E为Cl2,Fe与盐酸反应得到D为FeCl2,氯化亚铁氯气反应得到F为FeCl3,金属A与盐酸反应得到C与氢气,C与NaOH反应得到白色沉淀,且白色沉淀能溶于NaOH溶液与稀盐酸,则A为Al、C为AlCl3、白色沉淀为Al(OH)3,
(1)由以上分析可知A为Al,
故答案为:Al;
(2)反应F→D为氯化铁与铁生成氯化亚铁的反应,该反应的化学方程式是:为2FeCl3+Fe=3FeCl2,
故答案为:2FeCl3+Fe=3FeCl2;
(3)F中金属阳离子为Fe3+,常用试剂KSCN溶液检验,
故答案为:KSCN溶液;
(4)氢氧化钠为离子化合物,钠离子和氢氧根离子的表示方法不规范,其电子式为 ,
,
故答案为: .
.
点评 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,涉及Fe、Al、Cl元素单质化合物的性质,B的用途及转化关系特殊反应是推断突破口,难度不大,注意对基础知识的掌握.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
7.下列说法中正确的是( )
| A. | 所有铵盐受热均可以分解,产物均有NH3 | |
| B. | 所有铵盐都易溶于水,不是所有铵盐中的氮均呈-3价 | |
| C. | NH4Cl溶液中加入NaOH浓溶液共热,离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | NH4Cl和NaCl的固体混合物,可用升华法分离 |
8.如图为我国首次颁布的膳食宝塔示意图,其中X部分的食物是( )


| A. | 蔬菜 | B. | 谷类 | C. | 奶类 | D. | 肉类 |
5.某溶液中c(H+)>c(OH-),该溶液呈( )
| A. | 中性 | B. | 酸性 | C. | 碱性 | D. | 无法判断 |
9.下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是( )
| A. | 10℃3mol/L的盐酸溶液 | B. | 20℃2mol/L的盐酸溶液 | ||
| C. | 20℃2mol/L的盐酸溶液 | D. | 20℃4mol/L的盐酸溶液 |
6.以下属于取代反应的是( )
| A. | 乙烯与溴水的反应 | B. | 甲烷与氯气的反应 | ||
| C. | 乙醇与乙酸的反应 | D. | 苯的燃烧 |
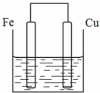 将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:(以下均假设反应过程中溶液体积不变).
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:(以下均假设反应过程中溶液体积不变).