题目内容
7.用右图所示装置模拟电解原理在工业生产上的应用.下列说法正确的是( )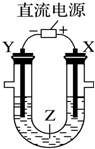
| A. | 氯碱工业中,X电极上反应式是4OH--4e-═2H2O+O2↑ | |
| B. | 电解精炼铜时,Z溶液中的铜离子浓度不变 | |
| C. | 在铁片上镀铜时,Y是纯铜 | |
| D. | 电解水制氢气时,Z可以是稀硫酸溶液 |
分析 A、依据电源正负极确定电解池中x为阳极,氯碱工业电解的是饱和食盐水,溶液中氯离子失电子;
B、电解精炼铜溶液中铜离子浓度减少;
C、铁片上镀铜时阴极为铁片;
D、电解水制氢气,在阴极上是氢离子得电子的还原反应,在阳极上是氢氧根离子失电子的氧化反应.
解答 解:A、氯碱工业中,X电极连接电源正极,为电解池的阳极,溶液中的氯离子失电子生成氯气,2Cl--2e-=Cl2↑,故A错误;
B、电解精炼铜时,粗铜做阳极含有铁、锌、镍等活泼金属,精铜做阴极,电解过程中电子守恒,溶液中的铜离子浓度减少,故B错误;
C、在铁片上镀铜时,铁片做阴极为Y电极,铜做阳极为X电极,故C错误;
D、电解水制氢气时,阴极上是氢离子得电子的还原反应,在阳极上是氢氧根离子失电子的氧化反应,电解质可以是稀硫酸,故D正确.
故选D.
点评 本题考查了氯碱工业,电解精炼铜,电镀铜,冶炼镁等几种工业制备的原理应用,熟练掌握电解原理是解题关键.

练习册系列答案
相关题目
17.如图所示,室温时甲、乙两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下止水夹K,使两烧瓶内气体充分接触后,容器内压强最大的是( )
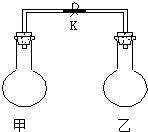
| 编号 | A | B | C | D |
| 甲中气体 | H2S | H2 | NH3 | NO |
| 乙中气体 | SO2 | Cl2 | HCl | O2 |

| A. | A | B. | B | C. | C | D. | D |
18.下列分子中的各原子不可能在同一平面上的是( )
| A. | C2H4 | B. | CH3CH3 | C. | CH2═CHCl | D. | C2H2 |
15.LED系列产品是一类新型节能产品.图甲是NaBH4/H2O2燃料电池,图乙是LED发光二极管的装置示意图.下列叙述错误的是( )
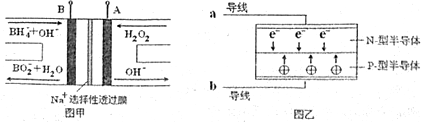

| A. | 电池A极区的电极反应式为:H2O2+2e-=2OH- | |
| B. | 电池放电过程中,Na+从负极区向正极区移动 | |
| C. | 每有1mol NaBH4参加反应转移电子数为4NA | |
| D. | 要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连 |
2.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 25℃时,1L pH=13的Ba(OH)2溶液中含有OH一的数目为0.2NA | |
| B. | 取50mL 14.0moI/L浓硝酸与足量的铜片反应,生成气体分子的数目为0.35NA | |
| C. | 标准状况下,2.24L二氧化硫中含有的电子总数为3.2NA | |
| D. | 40g金刚砂(SiC)中含有C-Si键的个数为2NA |
19.己知:Mn(s)+O2(g)═MnO2(s)△Hl
S(s)+O2(g)═SO2(g)△H2
Mn(s)+S(s)+2O2(g)═MnSO4(s)△H3
则下列表述正确的是( )
S(s)+O2(g)═SO2(g)△H2
Mn(s)+S(s)+2O2(g)═MnSO4(s)△H3
则下列表述正确的是( )
| A. | △H2>0 | |
| B. | △H3>△H1 | |
| C. | Mn+SO2═MnO2+S△H=△H2-△H1 | |
| D. | MnO2(s)+SO2(g)═MnSO4(s)△H═△H3-△H2-△H1 |
 在298K时,1mol C2H5OH在氧气中完全燃烧生成二氧化碳和液态水放出热量1366.8kJ.
在298K时,1mol C2H5OH在氧气中完全燃烧生成二氧化碳和液态水放出热量1366.8kJ.
 ;反应类型酯化反应会取代反应;
;反应类型酯化反应会取代反应;