题目内容
20.将9.36gNaCl与50g质量分数为98%,密度为1.84g/cm3的硫酸混合,微热使反应完全,再将所得气体全部通入44.16g水中完全吸收后,试求:(1)该浓硫酸的物质的量浓度;
(2)所得盐酸溶液的质量分数.
分析 (1)物质的量浓度C=$\frac{1000ρω%}{M}$;
(2)9.36g氯化钠的物质的量n=$\frac{9.36g}{58.5g/mol}$=0.16mol,50g质量分数为98%的浓硫酸中含有的硫酸的物质的量n=$\frac{50g×98%}{98g/mol}$=0.5mol.
在加热条件下,氯化钠和浓硫酸发生反应:2NaCl+H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$2HCl+Na2SO4,故可知浓硫酸过量,应根据氯化钠的物质的量来计算.设生成的HCl的物质的量为xmol,根据化学方程式可知:2NaCl+H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$2HCl+Na2SO4
2 2
0.16mol xmol
故能解得x.
然后根据所得溶液的质量分数=$\frac{{m}_{溶质}}{{m}_{溶质}+{m}_{溶剂}}×100%$来计算.
解答 解:(1)浓硫酸的物质的量浓度C=$\frac{1000ρω%}{M}$=$\frac{1000×1.84g/mL×98%}{98g/mol}$=18.4mol/L,
答:浓硫酸的浓度为18.4mol/L;
(2)9.36g氯化钠的物质的量n=$\frac{9.36g}{58.5g/mol}$=0.16mol,50g质量分数为98%的浓硫酸中含有的硫酸的物质的量n=$\frac{50g×98%}{98g/mol}$=0.5mol.
在加热条件下,氯化钠和浓硫酸发生反应:2NaCl+H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$2HCl+Na2SO4,故可知浓硫酸过量,应根据氯化钠的物质的量来计算.设生成的HCl的物质的量为xmol,根据化学方程式可知:2NaCl+H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$2HCl+Na2SO4
2 2
0.16mol xmol
故有:$\frac{2}{0.16mol}=\frac{2}{xmol}$
故x=0.16mol.
将0.16molHCl气体溶于44.16g水后所得溶液的质量分数=$\frac{{m}_{溶质}}{{m}_{溶质}+{m}_{溶剂}}×100%$=$\frac{0.16mol×36.5g/mol}{0.16mol×36.5g/mol+44.16g}×100%$=11.68%.
答:所得溶液的质量分数为11.68%.
点评 本题考查了学生利用化学方程式来进行计算的能力,难度不大,应注意物质的量浓度的计算公式的应用.

 快乐5加2金卷系列答案
快乐5加2金卷系列答案| A. | 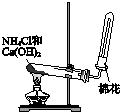 制备并收集氨气 | B. |  制备氯气 | ||
| C. | 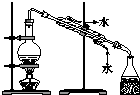 蒸馏海水得到淡水 | D. | 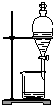 分离Na2CO3溶液与CH3COOC2H5 |
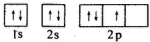
| A. | 洪特规则 | B. | 泡利原理 | C. | 能量最低原理 | D. | 洪特规则特例 |
| A. | HCl CuCl2 NaNO3 Na2SO4 | |
| B. | BaCl2 Na2CO3 HCl (NH4)2CO3 | |
| C. | FeCl3 HCl NaCl NaOH | |
| D. | Na2CO3 Na2SO4 HCl H2SO4 |
| A. | Q1+Q2>Q3 | B. | Q1+Q2<Q3 | C. | Q1+Q2>2Q3 | D. | Q1+Q2<2Q3 |
 2SO3(g) △H<0
2SO3(g) △H<0
