题目内容
10.用如图装置完成相关实验,不合理的是( )| A. | 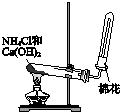 制备并收集氨气 | B. |  制备氯气 | ||
| C. | 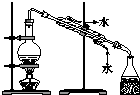 蒸馏海水得到淡水 | D. | 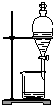 分离Na2CO3溶液与CH3COOC2H5 |
分析 A.铵盐与碱加热生成氨气,氨气的密度比空气密度小;
B.浓盐酸和二氧化锰应在加热条件下反应;
C.海水中水的沸点低,冷却水下进上出效果好;
D.Na2CO3溶液与CH3COOC2H5分层.
解答 解:A.铵盐与碱加热生成氨气,氨气的密度比空气密度小,则图中加热装置及向下排空气收集氨气均合理,故A正确;
B.浓盐酸和二氧化锰应在加热条件下反应,常温下不能制备氯气,故B错误;
C.海水中水的沸点低,冷却水下进上出效果好,图中蒸馏装置及冷却水的方向均合理,故C正确;
D.Na2CO3溶液与CH3COOC2H5分层,则图中分液装置可分离,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的制备、检验、混合物分离装置等,把握反应原理及实验技能为解答的关键,侧重分析与实验能力的考查,注意实验装置的作用及分析,题目难度不大.

练习册系列答案
相关题目
1.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L二氯甲烷的分子数约为NA个 | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol | |
| C. | 17.6 g丙烷中所含的极性共价键为4NA个 | |
| D. | 在过氧化钠与水的反应中,每生成0.1 mol氧气,转移电子的数目为0.4NA |
18. 如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定里NO,右室充入一定量O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4)( )
如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定里NO,右室充入一定量O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4)( )
 如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定里NO,右室充入一定量O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4)( )
如图所示,两个连通容器用活塞分开,左右两室体积相同,左室充入一定里NO,右室充入一定量O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应,下列判断正确的是(不考虑NO2转化为N2O4)( )| A. | 反应前后左室的压强相同 | |
| B. | 开始时左右两室中的分子数相同 | |
| C. | 反应后容器内的密度与反应前的相同 | |
| D. | 反应后容器内无O2存在 |
5.有四种化合物:①NaHCO3、②Al(OH)3、③(NH4)2S、④H2NCH2COOH,跟盐酸和氢氧化钠溶液都能反应的是( )
| A. | 只有②④ | B. | 只有①② | C. | 只有①②③ | D. | ①②③④ |
15.与CH2═CH2→CH2Br-CH2Br的变化属于同一反应类型的是( )
| A. | CH≡CH→CH2═CHCN | B. | C2H5Cl→CH2═CH2 | ||
| C. | C6H6→C6H6-NO2 | D. | CH3COOH→CH3COOC2H5 |
2.某研究性学习小组以酸性KMnO4溶液和草酸(H2C2O4,二元弱酸)溶液为例,研究影响化学反应速率的因素,设计如表方案:
(1)该反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(2)实验的记时方法是从溶液混合开始记时,至紫红色刚好褪去时,记时结束.
(3)实验①和②研究浓度对反应速率的影响,则V1=5.0mL,V2=3.0mL.
(4)下列有关该实验的叙述正确的是C、D.
A.实验时不能用量筒来量取液体的体积
B.实验时应将5.0mLKMnO4溶液与5.0mL H2C2O4溶液混合后,立即按下秒表,再将盛有混合液的烧杯置于相应温度的水浴中至反应结束时,按下秒表,记录读数.
C.在同一温度下,最好采用平行多次实验,以确保实验数据的可靠性
D.实验①和③可研究温度对反应速率的影响
(5)某小组在进行每组实验时,均发现该反应是开始很慢,突然会加快,其可能的原因是反应生成的Mn2+对反应有催化作用.
| 实验 编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 反应温度/℃ | 反应时间/s |
| ① | 5.0mL | 5.0mL | 0 | 20 | 125 |
| ② | V1 | V2 | 2.0mL | 20 | 320 |
| ③ | 5.0mL | 5.0mL | 0 | 50 | 30 |
(2)实验的记时方法是从溶液混合开始记时,至紫红色刚好褪去时,记时结束.
(3)实验①和②研究浓度对反应速率的影响,则V1=5.0mL,V2=3.0mL.
(4)下列有关该实验的叙述正确的是C、D.
A.实验时不能用量筒来量取液体的体积
B.实验时应将5.0mLKMnO4溶液与5.0mL H2C2O4溶液混合后,立即按下秒表,再将盛有混合液的烧杯置于相应温度的水浴中至反应结束时,按下秒表,记录读数.
C.在同一温度下,最好采用平行多次实验,以确保实验数据的可靠性
D.实验①和③可研究温度对反应速率的影响
(5)某小组在进行每组实验时,均发现该反应是开始很慢,突然会加快,其可能的原因是反应生成的Mn2+对反应有催化作用.
19.下列各组离子在指定溶液中能大量共存的是( )
| A. | 无色溶液中:K+、Na+、MnO4-、SO42- | |
| B. | 在酸性溶液中:Mg2+、Na+、SO42-、Cl- | |
| C. | 加入 Al 能放出 H2的溶液中:Cl-、HCO3-、SO42-、NH4+ | |
| D. | 酸性溶液中:K+、Cl-、NO3-、Fe2+ |

 .
.