题目内容
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)  2SO3(g) △H<0
2SO3(g) △H<0
(1)降低温度,二氧化硫转化率 ,化学反应速率 (以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是

(3)据图判断,反应进行至20min时,曲线发生变化的原因 (用文字表达)
(4)10min到15min的曲线变化的原因可能是 (填写编号)。
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加SO3的物质的量
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.与CH2═CH2→CH2Br-CH2Br的变化属于同一反应类型的是( )
| A. | CH≡CH→CH2═CHCN | B. | C2H5Cl→CH2═CH2 | ||
| C. | C6H6→C6H6-NO2 | D. | CH3COOH→CH3COOC2H5 |
16.下列一组粒子的中心原子杂化类型相同,分子或原子的键角不相等的是( )
| A. | SiCl4、金刚石 | B. | H2S、NF3 | C. | CH2═CHCl、环已烷 | D. | C6H6(苯)、CH3C≡CH |
13.下列关于1mo1•L-1的BaCl2溶液的叙述中.正确的是( )
| A. | 该溶液中C1-浓度为2mo1•L-1 | |
| B. | 该溶液中Ba2+的物质的量是1mo1 | |
| C. | 可使用250mL容量瓶分两次完成490mL该浓度的BaCl2溶液的配制 | |
| D. | 将208gBaCl2固体溶解在1L水中,形成的溶液的浓度为1mo1•L-1 |
金属钾和金属钠的金属性相近,但K比Na略强,当利用金属钠与KCl共熔制金属钾时,发现钾与钠的共熔体难以分离,如调整温度到一定程度,则可利用钠与KCl反应制取K,下面是四种物质的熔沸点:
K | Na | KCl | NaCl | |
熔点(℃) | 63.6 | 97.8 | 770 | 801 |
沸点(℃) | 774 | 882.9 | 1500 | 1413 |
根据平衡移动原理,可推知用Na与KCl反应制取金属钾的适宜温度是
A.低于770℃ B.850℃ C.高于882.9℃ D.1413~1500℃


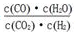 。恒容时,温度升高,H2浓度减小,下列说法正确的是
。恒容时,温度升高,H2浓度减小,下列说法正确的是 CO2+H2
CO2+H2
 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
 ,B中含氧官能团的名称是羧基.
,B中含氧官能团的名称是羧基. ;
; .
.