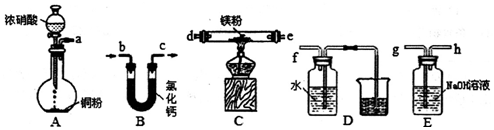
题目内容
4.下列有关气体体积的描述中正确的是( )| A. | 标准状况下,22.4LCCl4含有的分子数约为6.02×1023个 | |
| B. | 1L氢气一定比1L氧气质量少 | |
| C. | 含有6.02×1023个Fe3+的Fe2(SO4)3中SO42-的物质的量为3mol | |
| D. | 1molAl3+带有的正电荷数为3NA |
分析 A.标准状况下,CCl4为液体;
B.状态不知道,无法计算气体的物质的量和质量;
C.根据n=$\frac{N}{{N}_{A}}$计算Fe3+的物质的量,由化学式可知n(SO42-)=$\frac{3}{2}$n(Fe3+);
D.根据Al3+中正电荷数计算.
解答 解:A.标准状况下,CCl4为液体,不能用气体摩尔体积计算,故A错误;
B.状态不知道,无法计算气体的物质的量和质量,所以不能比较氢气和氧气的质量大小,故B错误;
C.Fe3+的物质的量为$\frac{6.02×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=1mol,由化学式可知n(SO42-)=$\frac{3}{2}$n(Fe3+)=1mol×$\frac{3}{2}$=1.5mol,故C错误;
D.1molAl3+带有的正电荷的物质的量为3mol,则正电荷数为3NA,故D正确.
故选D.
点评 本题考查了物质的量有关计算,题目难度不大,注意把握气体摩尔体积的适用条件、微粒之间的数目关系,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.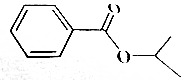 某有机物结构如图所示,有关该物质的叙述正确的是( )
某有机物结构如图所示,有关该物质的叙述正确的是( )
 某有机物结构如图所示,有关该物质的叙述正确的是( )
某有机物结构如图所示,有关该物质的叙述正确的是( )| A. | 该物质易溶于水,不溶于乙醇、乙醚 | |
| B. | 该物质能发生加成、氧化.水解等反应 | |
| C. | 1mol该物质最多能与4mol氢气加成 | |
| D. | 该物质所有碳原子可能共平面 |
14.分子式为C3H6O2的有机物有多种同分异构体,现有其中的四种X、Y、Z、W,它们的分子中均含甲基,将它们分别进行下列实验以鉴别,其实验记录如下:
请写出四种物质的结构简式:XCH3CH2COOH,YCH3CHOHCHO,ZHCOOCH2CH3,WCH3COOCH3.
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
| X | 中和反应 | 无现象 | 溶解 | 产生氢气 |
| Y | 无现象 | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
| Z | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | 无现象 |
| W | 水解反应 | 无现象 | 无现象 | 无现象 |
11.今年来,天津连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)利用钠碱循环法可脱除烟气中的SO2.
①在钠碱循环法中,Na2SO3溶液可作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O.
②吸收液吸收SO2的过程中,pH随m(SO32-):m(HSO3-)变化关系如下表:
由上表判断,NaHSO3溶液显酸性(填“酸、”“碱”或“中”),用化学平衡原理解释:HSO3-存在HSO3-?H++SO32- 和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度.
③当吸收液的pH将至约为6时,需送至电解槽再生,再生示意图如下:

写出HSO3-在阳极放电的电极反应式:HSO3-+H2O-2e-=SO42-+3H+,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.
(2)用CH4催化还原NO2可以消除氮氧化的污染,例如:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O,△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O,△H=-1160kJ•mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为1.60NA(或1.6NA)(阿伏伽德罗常数的值用NA表示),放出的热量为173.4kJ.
(3)工业上合成氨所需氢气的制备过程中,其中的一步反应为:
CO(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{\;}$CO2(g)+H2(g):△H<0
一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6,则平衡常数K=2.67(计算结果保留两位小数).
(1)利用钠碱循环法可脱除烟气中的SO2.
①在钠碱循环法中,Na2SO3溶液可作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O.
②吸收液吸收SO2的过程中,pH随m(SO32-):m(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
③当吸收液的pH将至约为6时,需送至电解槽再生,再生示意图如下:

写出HSO3-在阳极放电的电极反应式:HSO3-+H2O-2e-=SO42-+3H+,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.
(2)用CH4催化还原NO2可以消除氮氧化的污染,例如:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O,△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O,△H=-1160kJ•mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为1.60NA(或1.6NA)(阿伏伽德罗常数的值用NA表示),放出的热量为173.4kJ.
(3)工业上合成氨所需氢气的制备过程中,其中的一步反应为:
CO(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{\;}$CO2(g)+H2(g):△H<0
一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6,则平衡常数K=2.67(计算结果保留两位小数).
9.下列单质中,与水或与酸反应最剧烈的是( )
| A. | Li | B. | Na | C. | Mg | D. | Al |
16. 用右图所示装置除去含CN-、CI-废水中的CN-时,控制溶液pH为9-10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用右图所示装置除去含CN-、CI-废水中的CN-时,控制溶液pH为9-10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
 用右图所示装置除去含CN-、CI-废水中的CN-时,控制溶液pH为9-10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用右图所示装置除去含CN-、CI-废水中的CN-时,控制溶液pH为9-10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | 用石墨作阳极,铁作阴极 | |
| B. | 阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极的电极反应式为:2H++2e-=H2↑ | |
| D. | 除去CN-的反应:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O |
14.对中国古代著作涉及化学的叙述,下列说法错误的是( )
| A. | 《天工开物》中“凡石灰,经火焚炼为用”里的“石灰”指的是Ca(OH)2 | |
| B. | 《黄白第十六》中“曾青涂铁,铁赤如铜”,其“曾青”是可溶性铜盐 | |
| C. | 《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K2CO3 | |
| D. | 《汉书》中“高奴县有洧水可燃”,这里的“洧水”指的是石油 |