题目内容
11.今年来,天津连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.(1)利用钠碱循环法可脱除烟气中的SO2.
①在钠碱循环法中,Na2SO3溶液可作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O.
②吸收液吸收SO2的过程中,pH随m(SO32-):m(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
③当吸收液的pH将至约为6时,需送至电解槽再生,再生示意图如下:

写出HSO3-在阳极放电的电极反应式:HSO3-+H2O-2e-=SO42-+3H+,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.
(2)用CH4催化还原NO2可以消除氮氧化的污染,例如:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O,△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O,△H=-1160kJ•mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为1.60NA(或1.6NA)(阿伏伽德罗常数的值用NA表示),放出的热量为173.4kJ.
(3)工业上合成氨所需氢气的制备过程中,其中的一步反应为:
CO(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{\;}$CO2(g)+H2(g):△H<0
一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6,则平衡常数K=2.67(计算结果保留两位小数).
分析 (1)①二氧化硫和氢氧化钠反应生成亚硫酸钠和水,注意弱电解质写化学式;
②根据溶液中亚硫酸氢根离子浓度和亚硫酸根离子浓度的相对大小确定溶液的酸碱性;
③阳极上阴离子失电子发生氧化反应;
(2)利用盖斯定律计算反应热;
(3)根据反应前和反应后一氧化碳和水之间的体积比结合反应方程式计算出平衡时各种物质的物质的量浓度,再根据平衡常数公式进行计算.
解答 解:(1)①酸性氧化物和碱反应生成盐和水,所以二氧化硫和氢氧化钠反应生成亚硫酸钠和水,反应方程式为2OH-+SO2=SO32-+H2O,
故答案为:2OH-+SO2=SO32-+H2O;
②在溶液中主要以HSO3-存在,HSO3-的电离很微弱,所以n(SO32-):n(HSO3-)<1:1,根据表格知,当亚硫酸氢根离子的物质的量大于亚硫酸根离子的物质的量时,亚硫酸氢钠溶液呈酸性,亚硫酸氢根离子既能水解又能电离,亚硫酸氢钠溶液呈酸性同时说明HSO3-的电离程度大于水解程度,
故答案为:酸性;HSO3-存在HSO3-?H++SO32- 和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度;
③阳极上亚硫酸氢根离子失电子和水反应生成硫酸根离子和氢离子,电极反应式为:HSO3-+H2O-2e-=SO42-+3H+,
故答案为:HSO3-+H2O-2e-=SO42-+3H+;
(2)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol
利用盖斯定律将$\frac{①+②}{2}$得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ/mol
n(CH4)=$\frac{4.48L}{22.4L/mol}$,整个过程中转移的电子总数为:0.20mol×8NA=1.60NA,放出的热量为:0.2mol×867kJ/mol=173.4kJ,
故答案为:1.60NA(或1.6NA);173.4;
(3)同一容器中各气体的物质的量之比等于其体积之比,
设容器的体积为1L,加入的一氧化碳的物质的量为1mol,则水的物质的量为2mol,假设平衡时一氧化碳的物质的量为x,
CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
开始 1mol 2mol 0 0
反应 1-x 2-6x 1-x 1-x
平衡 x 6x 1-x 1-x
则:(1-x):(2-6x)=1:1,x=0.2mol,
所以平衡时,c(CO)=0.2mol/L,c(H2O)=1.2mol/L,c(H2)=C(CO2)=0.8mol/L,
K=$\frac{0.8×0.8}{0.2×1.2}$=$\frac{8}{3}$≈2.67,
故答案为:2.67.
点评 本题考查较为综合,涉及离子方程式、电极反应式的书写和化学平衡常数的计算等知识点,明确同一体系中气体的物质的量之比等于其体积之比是解(3)题的关键,注意电极反应式的书写是高考热点,难度中等.

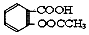 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128-135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如图:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128-135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如图: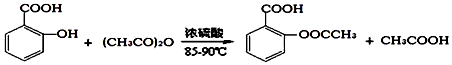
操作流程如图:
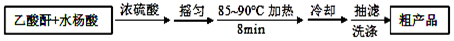
主要试剂和产品的物理常数:
| 名 称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是醋酸酐易水解.
(2)合成过程中最合适的加热方法是水浴加热.
(3)提纯粗产品流程如下,加热回流的装置如图所示:
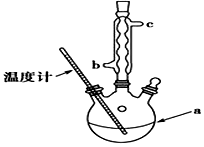
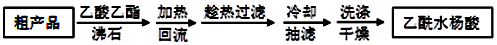
①a仪器的名称三颈烧瓶,冷凝水的流出方向是c(填“b”或“c”).
②趁热过滤的原因是防止乙酰水杨酸结晶析出.
③检验最终产品中是否含有水杨酸的化学方法是取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若呈紫蓝色则含水杨酸.
④下列说法正确的是ab.
a.此种提纯方法中乙酸乙酯的作用是作溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时大.
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称量产品质量为2.2g,则所得乙酰水杨酸的产率为84.3%.(用百分数表示,保留至小数点后一位)
| A. | 1mol Cl2参加反应转移电子数一定为2NA | |
| B. | 1mol NaHCO3晶体中阳离子数为2NA | |
| C. | 常温常压条件下,14g乙烯和丁烯混合物含有的共用电子对数为3NA | |
| D. | 1ml•L-1 NaCl溶液中含有的Na+数为NA |
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5.则下列有关比较中正确的是( )
| A. | 第一电离能:③>②>① | B. | 原子半径:③>②>① | ||
| C. | 电负性:③>①>② | D. | 最高化合价:②>①>③ |
| A. | 甲酸 | B. | 乙醛 | C. | 甘油 | D. | 果糖 |
| A. | 常温常压下,氯气的摩尔质量等于71g | |
| B. | 1molH2SO4中含有2mol氢元素 | |
| C. | 某物质的摩尔质量就是该物质的相对分子质量或相对原子质量 | |
| D. | 2g氦气所含的原子数目约为0.5×6.02×1023 |
| A. | 标准状况下,22.4LCCl4含有的分子数约为6.02×1023个 | |
| B. | 1L氢气一定比1L氧气质量少 | |
| C. | 含有6.02×1023个Fe3+的Fe2(SO4)3中SO42-的物质的量为3mol | |
| D. | 1molAl3+带有的正电荷数为3NA |
| A | B | C | D |
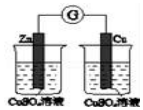 | 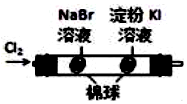 | 将稀盐酸与碳酸钠 溶液混合 | 5%的H2O2溶 液中滴入2滴 1molL-1氯化 铁溶液 |
| 验证化学能 转化为电能 | 验证氧化性Cl2>Br2>I2 | 验证氯比氮的非金属性强 | 验证催化剂加快 反应速率 |
| A. | A | B. | B | C. | C | D. | D |
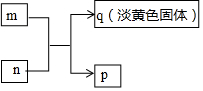 X、Y、Z、W是原子序数依次增大的短周期主族元素,其中Y、W同主族,W的最外层电子数为Z的2倍,m、n分别是X、Y与W形成的化合物,m、n有如图所示的转化关系,p为常见的液态化合物,q是W的单质.下列说法不正确的是( )
X、Y、Z、W是原子序数依次增大的短周期主族元素,其中Y、W同主族,W的最外层电子数为Z的2倍,m、n分别是X、Y与W形成的化合物,m、n有如图所示的转化关系,p为常见的液态化合物,q是W的单质.下列说法不正确的是( )| A. | 原子半径:Z>W>Y>X | |
| B. | 简单氢化物的稳定性:Y>W | |
| C. | m、n、p均为只含极性键的共价化合物 | |
| D. | Z、W形成的化合物可由两种盐溶液通过复分解反应制得 |