题目内容
6.室温时,将足量的氯化银固体分别加入①10mL蒸馏水中;②30mL0.1mol/L盐酸;③5mL0.3mol/L食盐溶液;④10mL0.2mol/L氯化钙溶液中.均使氯化银溶解并达到饱和,此时所得各种溶液中,银离子浓度由大到小的顺序是( )| A. | ①②③④ | B. | ①②④③ | C. | ①③②④ | D. | ④③①② |
分析 在AgCl饱和溶液中存在沉淀溶解平衡:AgCl(s)=Ag+(aq)+Cl-(aq),加入氯离子平衡逆向移动,氯化银溶解度减小,银离子浓度减小,以此来解答.
解答 解:在AgCl饱和溶液中存在沉淀溶解平衡:AgCl(s)=Ag+(aq)+Cl-(aq),
①10mL蒸馏水中c(Cl-)=0;
②30mL0.1mol/L盐酸中c(Cl-)=0.1mol/L;
③5mL0.3mol/L食盐溶液中c(Cl-)=0.3mol/L;
④10mL0.2mol/L氯化钙溶液中c(Cl-)=0.2mol/L×2=0.4mol/L,
加入氯离子平衡逆向移动,氯化银溶解度减小,银离子浓度减小,
加入Cl-浓度从大到小顺序为④③②①,则银离子浓度由大到小的顺序是①②③④,
故选A.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握氯离子浓度的计算及平衡移动为解答的关键,侧重分析与应用能力的考查,注意平衡移动原理的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17. 头孢克洛是人工合成的第二代口服头孢菌抗生素,主耍用于呼吸道感染、中耳炎、尿道感染等疾病的治疗,其结构如图所示,下列关于头孢克洛的说法错误的是( )
头孢克洛是人工合成的第二代口服头孢菌抗生素,主耍用于呼吸道感染、中耳炎、尿道感染等疾病的治疗,其结构如图所示,下列关于头孢克洛的说法错误的是( )
 头孢克洛是人工合成的第二代口服头孢菌抗生素,主耍用于呼吸道感染、中耳炎、尿道感染等疾病的治疗,其结构如图所示,下列关于头孢克洛的说法错误的是( )
头孢克洛是人工合成的第二代口服头孢菌抗生素,主耍用于呼吸道感染、中耳炎、尿道感染等疾病的治疗,其结构如图所示,下列关于头孢克洛的说法错误的是( )| A. | 分子式可以表示为C15H16C1N306S | |
| B. | 既能和盐酸反应又能和烧碱溶液反应 | |
| C. | 分子结构中有3个手性碳原子 | |
| D. | 1mol该化合物与NaOH溶液作用时消耗NaOH的物质的量最多为4mol |
14.下列有关海水淡化的叙述不正确的是( )
| A. | 离子交换法淡化海水发生了化学变化 | |
| B. | 海水淡化可为人类提供更多的淡水资源 | |
| C. | 利用太阳能蒸发原理淡化海水属于物理变化 | |
| D. | 将海水中的盐分离出来不能达到海水淡化的目的 |
11.发展生物柴油具有战略意义,生物柴油就是以大豆、油菜籽等油料作物、工程微藻等水生植物以及动物油脂、废餐饮油等为原料制成的液体燃料,是优质的石油、柴油代用品.据以上信息,下列有关生物柴油的说法错误的是( )
| A. | 生物柴油是可再生能源 | |
| B. | 发展生物柴油也有益于保护生态环境 | |
| C. | 生物柴油的组成成分与矿物柴油完全相同 | |
| D. | 发展生物柴油有利于调整产业结构、增加农民收入 |
18.下列物质中,含有金属键的是( )
| A. | 干冰 | B. | 金刚石 | C. | 食盐 | D. | 白银 |
16.铝与铍的性质相似.下列关于铍的性质推断中,正确的是( )
| A. | 氯化铍的水溶液呈酸性 | B. | 氢氧化铍可溶于水 | ||
| C. | 铍只与酸反应不与碱反应 | D. | 氧化铍的化学式为Be2O3 |
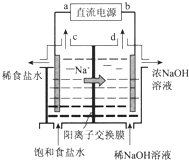 用石墨电极电解饱和NaCl溶液的装置如图所示,请回答:
用石墨电极电解饱和NaCl溶液的装置如图所示,请回答: