题目内容
1.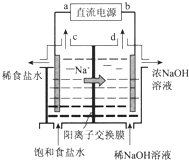 用石墨电极电解饱和NaCl溶液的装置如图所示,请回答:
用石墨电极电解饱和NaCl溶液的装置如图所示,请回答:(1)电解饱和NaCl溶液的总反应方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
(2)a端是直流电源的正(填“负”或“正”)极.
(3)阳极上发生的反应式是2C1--2e-=Cl2↑.
(4)结合电极反应式说明电解池右侧NaOH溶液浓度增大的原因是阴极是2H2O+2e-=H2↑+2OH-,Na+由阳极区移向阴极区,消耗水且生成了NaOH.
分析 (1)电解饱和NaCl溶液,得到氢氧化钠、氯气和氢气,反应的方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(2)钠离子向右边移动,右边是阴极,所以a端是直流电源的正极;
(3)阳极上是氯离子发生氧化反应,电极反应式为:2C1--2e-=Cl2↑;
(4)电解池右侧是阴极,水中的氢离子放电,生成氢氧根离子,而钠离子由极区移向阴极区,与氢氧根离子结合,产生NaOH.
解答 解:(1)电解饱和NaCl溶液,得到氢氧化钠、氯气和氢气,反应的方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(2)钠离子向右边移动,右边是阴极,所以a端是直流电源的正极,故答案为:正;
(3)阳极上是氯离子发生氧化反应,电极反应式为:2C1--2e-=Cl2↑,故答案为:2C1--2e-=Cl2↑;
(4)电解池右侧是阴极,水中的氢离子放电,生成氢氧根离子,而钠离子由极区移向阴极区,与氢氧根离子结合,产生NaOH,
故答案为:阴极是2H2O+2e-=H2↑+2OH-,Na+由阳极区移向阴极区,消耗水且生成了NaOH.
点评 本题考查了电解原理的分析应用,电极反应的书写和离子的移动方向,题目难度中等,学生只要掌握电解的原理就可以迅速解题了.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
12.下列化学用语正确的是( )
| A. | H2O2的电子式  | B. | CO2的比例模型 | ||
| C. | S2-的结构示意图 | D. | 次氯酸的结构式:H-0-Cl |
9.下列各反应达到平衡后,减小压强或升高温度都能使化学平衡向正反应方向移动的是( )
| A. | N2(g)+3H2(g)?2NH3(g) (正反应为放热反应) | |
| B. | C(s)+CO2(g)?2CO(g) (正反应为吸热反应) | |
| C. | 2NO2(g)?N2O4(g) (正反应为放热反应) | |
| D. | 3O2(g)?2O3(g) (正反应为吸热反应) |
16.下列关于化学键的叙述正确的是( )
| A. | 离子化合物一定不含共价键 | B. | 化学键的形成与原子结构无关 | ||
| C. | 共价键只存在于共价化合物中 | D. | 离子键只存在于离子化合物中 |
6.室温时,将足量的氯化银固体分别加入①10mL蒸馏水中;②30mL0.1mol/L盐酸;③5mL0.3mol/L食盐溶液;④10mL0.2mol/L氯化钙溶液中.均使氯化银溶解并达到饱和,此时所得各种溶液中,银离子浓度由大到小的顺序是( )
| A. | ①②③④ | B. | ①②④③ | C. | ①③②④ | D. | ④③①② |
13.下列装置能达到实验目的是( )
| A. |  实验室制取并收集氨气 | B. |  吸收氨气 | ||
| C. |  代替启普发生器 | D. |  排空气法收集二氧化碳 |
10.能得到Fe2O3 的实验是( )
| A. | 铁在纯氧中燃烧 | B. | 红热的铁和水蒸气反应 | ||
| C. | 蒸干并灼烧Fe2(SO4)3溶液 | D. | 灼烧氢氧化铁固体 |
11.下列物质属于纯净物的是( )
| A. | 硬铝 | B. | 不锈钢 | C. | 胆矾 | D. | 铝热剂 |