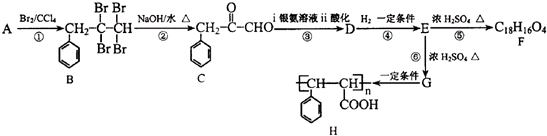
题目内容
我国化工专家侯德榜,勇于创新,改进氨碱法设计了“联合制碱法”,曾为世界制碱工业做出了突出贡献.氨碱法和“联合制碱法”是两大重要的工业制减法,共同点均以食盐(氯化钠)、二氧化碳、氨气为原料制备,生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液,请回答下列问题:
(1)“联合制碱法”制得的“碱”是 (填化学式).
某实验小组,利用下列装置模拟“联合制碱法”.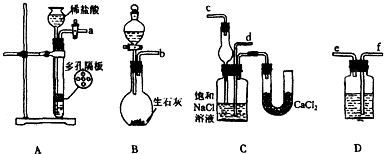
(2)取上述仪器连接装置,顺序为:(a)接 , 接 ;(b)接 .
检验装置气密性后装入药品,先让 装置(填上述字母)先发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体.
(3)C中用球形干燥管而不用直导管,其作用是 ,D中应选用的液体为
(4)C中广口瓶内产生固体的总化学方程式为
(5)产品纯碱中含有碳酸氢钠.如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为: (注明你的表达式中所用的有关符号的含义)
(1)“联合制碱法”制得的“碱”是
某实验小组,利用下列装置模拟“联合制碱法”.

(2)取上述仪器连接装置,顺序为:(a)接
检验装置气密性后装入药品,先让
(3)C中用球形干燥管而不用直导管,其作用是
(4)C中广口瓶内产生固体的总化学方程式为
(5)产品纯碱中含有碳酸氢钠.如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:
考点:纯碱工业(侯氏制碱法)
专题:实验题
分析:(1)联碱法是以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取纯碱;
(2)根据装置A制取CO2,装置B制取NH3,装置D除去二氧化碳中的HCl,二氧化碳与氨气通入C中应防止倒吸,据此分析连接仪器装置,CO2在水中的溶解度较小,吸收率低;后通入CO2保证全部生成NaHCO3;
(3)C中用球形干燥管球形部分空间大,液面上升能起缓冲作用;
(4)根据候氏制碱法是以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取纯碱结合装置图分析解答;
(5)根据碳酸氢钠受热易分解和碳酸钠受热稳定的性质来回答;
(2)根据装置A制取CO2,装置B制取NH3,装置D除去二氧化碳中的HCl,二氧化碳与氨气通入C中应防止倒吸,据此分析连接仪器装置,CO2在水中的溶解度较小,吸收率低;后通入CO2保证全部生成NaHCO3;
(3)C中用球形干燥管球形部分空间大,液面上升能起缓冲作用;
(4)根据候氏制碱法是以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取纯碱结合装置图分析解答;
(5)根据碳酸氢钠受热易分解和碳酸钠受热稳定的性质来回答;
解答:
解:(1)我国制碱工业的先驱---侯德榜发明的联合制碱法中的“碱”是纯碱,是碳酸钠的俗称,其化学式为:Na2CO3,
故答案为:Na2CO3;
(2)足量的CO2与NaOH反应生成NaHCO3,装置A产生CO2,装置B产生NH3,装置D除去二氧化碳中的HCl,二氧化碳与氨气通入C中应防止倒吸,则b接c,故a接f、e接d,
先通入氨气,氨气与水形成呈碱性的氨水可与二氧化碳与水生成的碳酸发生反应,更有利于二氧化碳气体的吸收,故应先发生氨气的制备反应,
故答案为:f、e、d、c;B;
(3)氨气极易溶于水,用直导管向饱和氯化钠溶液中通入氨气,容易发生倒吸,C中用球形干燥管可以防止倒吸,
故答案为:防倒吸;饱和NaHCO3溶液;
(4)侯氏制碱法,也称为联合制碱法,化学反应原理是用氨气和二氧化碳与氯化钠饱和溶液反应生成碳酸氢钠,然后加热碳酸氢钠制取碳酸钠,反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,
故答案为:CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl;
(5)设m1表示加热前纯碱样品的质量,m2表示加热后固体的质量,则加热损失的质量为:m1-m2,故纯碱中含有的碳酸氢钠的质量分数为W(NaHCO3)=
,
故答案为:W(NaHCO3)=
,( m1为样品质量,m2为加热后产品的质量);
故答案为:Na2CO3;
(2)足量的CO2与NaOH反应生成NaHCO3,装置A产生CO2,装置B产生NH3,装置D除去二氧化碳中的HCl,二氧化碳与氨气通入C中应防止倒吸,则b接c,故a接f、e接d,
先通入氨气,氨气与水形成呈碱性的氨水可与二氧化碳与水生成的碳酸发生反应,更有利于二氧化碳气体的吸收,故应先发生氨气的制备反应,
故答案为:f、e、d、c;B;
(3)氨气极易溶于水,用直导管向饱和氯化钠溶液中通入氨气,容易发生倒吸,C中用球形干燥管可以防止倒吸,
故答案为:防倒吸;饱和NaHCO3溶液;
(4)侯氏制碱法,也称为联合制碱法,化学反应原理是用氨气和二氧化碳与氯化钠饱和溶液反应生成碳酸氢钠,然后加热碳酸氢钠制取碳酸钠,反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,
故答案为:CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl;
(5)设m1表示加热前纯碱样品的质量,m2表示加热后固体的质量,则加热损失的质量为:m1-m2,故纯碱中含有的碳酸氢钠的质量分数为W(NaHCO3)=
| 84(m1-m2) |
| 31m1 |
故答案为:W(NaHCO3)=
| 84(m1-m2) |
| 31m1 |
点评:本题是一道有关工业制纯碱知识的一道综合实验题目,考查学生分析和解决问题的能力,掌握“联合制碱法”的原理是解题的关键,题目难度中等.

练习册系列答案
相关题目
下列关于氧化还原反应的说法,正确的是( )
| A、氧化还原反应的特征是电子的转移 |
| B、氧化剂在反应中被还原,生成氧化产物 |
| C、同一反应中,氧化剂得电子的总数一定等于还原剂失电子的总数 |
| D、任何反应中一定有氧化剂和还原剂,且氧化剂和还原剂可以为同种物质 |
用惰性电极在U形管中电解下列物质的水溶液,消耗相同的电量时,U形管中有固体析出时在相同条件下收集的气体体积最大是( )
| A、AlCl3溶液 |
| B、AgNO3溶液 |
| C、Na2SO4溶液 |
| D、NaOH溶液 |
反应:aX(g)+bY(g)?cZ(g),达到平衡时测得X气体的浓度为1mol/L,在恒温下将该容器体积扩大一倍,再次达到平衡时,测得X气体的浓度为0.6mol/L,则下列叙述正确的是( )
| A、a+b<c |
| B、平衡向生成Z的方向移动 |
| C、Z的体积分数降低 |
| D、Y的转化率升高 |
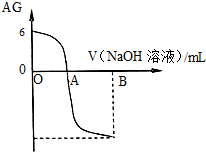 有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg
有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg| c(H+) |
| c(OH-) |
| A、A点时加入氢氧化钠溶液体积为20 mL |
| B、室温时0.01 mol/L的醋酸溶液pH=4 |
| C、OA段溶液中:c(CH3COO-)>c(CH3COOH) |
| D、若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH)+c(H+)=c(OH-) |
已知如下两个热化学反应方程式:下列说法错误的是( )
 (1)+H2(g)→
(1)+H2(g)→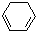 (1)-Q ①
(1)-Q ①
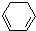 (1)+2H2(g)→
(1)+2H2(g)→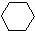 (1)+Q ②
(1)+Q ②
 (1)+H2(g)→
(1)+H2(g)→ (1)-Q ①
(1)-Q ① (1)+2H2(g)→
(1)+2H2(g)→ (1)+Q ②
(1)+Q ②| A、反应①、②都属于加成反应 |
| B、1,3-环己二烯比苯稳定 |
| C、反应①、②的热效应说明苯环中含有的并不是碳碳双键 |
| D、反应①、②中的所有有机物均可使溴水褪色,但褪色原理不完全相同 |