题目内容
实验室中可用盐酸滴定的方法测定Na2CO3或NaHCO3的含量.测定Na2CO3时,若用酚酞作指示剂,逐滴加入盐酸至溶液由红色变无色时Na2CO3完全转化为NaHCO3;测定NaHCO3时,若用甲基橙作指示剂,逐滴加入盐酸至溶液由黄色变橙色时NaHCO3完全转化为CO2逸出.(化学式量:Na2CO3-106,NaHCO3-84)
(1)某天然碱的化学式为xNa2CO3?NaHCO3?2H2O,为了测定其组成,取0.3320g样品于锥形瓶中,加适量蒸馏水使之溶解,加入几滴酚酞,用0.1000mol?L-1的盐酸滴定至溶液由红色变无色,消耗盐酸20.00mL;再向已变无色的溶液中加入几滴甲基橙,继续用该盐酸滴定至溶液由黄色变橙色,又消耗盐酸30.00mL.
①实验时用到的玻璃仪器有烧杯、胶头滴管、锥形瓶、 ;
②酚酞由红色变无色的过程中,溶液中的离子之间发生反应的离子方程式为 ;
③该天然碱化学式中x= ;
(2)某学习小组在实验室中制备Na2CO3,假设产品中含有少量NaCl、NaHCO3杂质,设计实验方案进行检验,完成表格.
限选试剂:0.1000mol?L-1盐酸、稀硝酸、AgNO3溶液、酚酞、甲基橙、蒸馏水
(1)某天然碱的化学式为xNa2CO3?NaHCO3?2H2O,为了测定其组成,取0.3320g样品于锥形瓶中,加适量蒸馏水使之溶解,加入几滴酚酞,用0.1000mol?L-1的盐酸滴定至溶液由红色变无色,消耗盐酸20.00mL;再向已变无色的溶液中加入几滴甲基橙,继续用该盐酸滴定至溶液由黄色变橙色,又消耗盐酸30.00mL.
①实验时用到的玻璃仪器有烧杯、胶头滴管、锥形瓶、
②酚酞由红色变无色的过程中,溶液中的离子之间发生反应的离子方程式为
③该天然碱化学式中x=
(2)某学习小组在实验室中制备Na2CO3,假设产品中含有少量NaCl、NaHCO3杂质,设计实验方案进行检验,完成表格.
限选试剂:0.1000mol?L-1盐酸、稀硝酸、AgNO3溶液、酚酞、甲基橙、蒸馏水
| 实验步骤 | 结果分析 |
| 步骤1:取少量样品于试管中,加入适量蒸馏水使之溶解, | 若有白色沉淀生成,说明产品中含有NaCl. |
| 步骤2:另取少量样品于锥形瓶中,加入适量蒸馏水使之溶解,加入几滴酚酞,用0.1000mol?L-1盐酸滴定至溶液由红色变无色,记录消耗盐酸的体积V1. | 若 |
考点:探究物质的组成或测量物质的含量,制备实验方案的设计
专题:
分析:(1)①溶解样品还需要玻璃棒玻璃棒;滴定是还需要酸式滴定管盛放盐酸;
②若用酚酞作指示剂,逐滴加入盐酸至溶液由红色变无色时Na2CO3完全转化为NaHCO3;
③两次消耗的盐酸分别是20ml和30ml,因此根据方程式可知,样品中碳酸钠和碳酸氢钠的物质的量之比是2:1,以此确定x;
(2)检验氯离子一般用硝酸酸化的硝酸银溶液,现象是生成氯化银白色沉淀;根据反应的方程式可知,如果含有碳酸氢钠,则第二次消耗的盐酸体积大于第一次消耗的盐酸体积.
②若用酚酞作指示剂,逐滴加入盐酸至溶液由红色变无色时Na2CO3完全转化为NaHCO3;
③两次消耗的盐酸分别是20ml和30ml,因此根据方程式可知,样品中碳酸钠和碳酸氢钠的物质的量之比是2:1,以此确定x;
(2)检验氯离子一般用硝酸酸化的硝酸银溶液,现象是生成氯化银白色沉淀;根据反应的方程式可知,如果含有碳酸氢钠,则第二次消耗的盐酸体积大于第一次消耗的盐酸体积.
解答:
解:(1)①溶解样品还需要玻璃棒玻璃棒;滴定是还需要酸式滴定管盛放盐酸;故答案为:玻璃棒、酸式滴定管;
②若用酚酞作指示剂,逐滴加入盐酸至溶液由红色变无色时Na2CO3完全转化为NaHCO3;离子方程式为:CO32-+H+=HCO3-,故答案为:CO32-+H+=HCO3-;
③第一次滴定发生的离子反应为:CO32-+H+=HCO3-、第二次发生的离子反应为:CO32-+2H+=CO2↑+H2O,又由于两次消耗的盐酸分别是20ml和30ml,可知样品中碳酸钠和碳酸氢钠的物质的量之比是2:1的,所以x=2,故答案为:2;
(2)检验氯离子一般用硝酸酸化的硝酸银溶液,现象是生成氯化银白色沉淀;根据反应的方程式可知,如果含有碳酸氢钠,则第二次消耗的盐酸体积大于第一次消耗的盐酸体积,即V2>V1,故答案为:①滴加足量的稀硝酸酸化,再加几滴硝酸银溶液;②再向一变无色的溶液中滴加几滴甲基橙,继续用该盐酸溶液滴定至溶液由黄色变成橙色;V2>V1;故答案为:滴加足量稀硝酸酸化,再滴加几滴AgNO3溶液,再向已变无色的溶液中滴加几滴甲基橙,继续用该盐酸滴定至溶液由黄色变为橙色,V2>V1.
②若用酚酞作指示剂,逐滴加入盐酸至溶液由红色变无色时Na2CO3完全转化为NaHCO3;离子方程式为:CO32-+H+=HCO3-,故答案为:CO32-+H+=HCO3-;
③第一次滴定发生的离子反应为:CO32-+H+=HCO3-、第二次发生的离子反应为:CO32-+2H+=CO2↑+H2O,又由于两次消耗的盐酸分别是20ml和30ml,可知样品中碳酸钠和碳酸氢钠的物质的量之比是2:1的,所以x=2,故答案为:2;
(2)检验氯离子一般用硝酸酸化的硝酸银溶液,现象是生成氯化银白色沉淀;根据反应的方程式可知,如果含有碳酸氢钠,则第二次消耗的盐酸体积大于第一次消耗的盐酸体积,即V2>V1,故答案为:①滴加足量的稀硝酸酸化,再加几滴硝酸银溶液;②再向一变无色的溶液中滴加几滴甲基橙,继续用该盐酸溶液滴定至溶液由黄色变成橙色;V2>V1;故答案为:滴加足量稀硝酸酸化,再滴加几滴AgNO3溶液,再向已变无色的溶液中滴加几滴甲基橙,继续用该盐酸滴定至溶液由黄色变为橙色,V2>V1.
点评:本题考查了滴定法,注意滴定法测定物质含量的主要操作及注意事,在本题中由所给信息可知,当以酚酚为指示剂时,NaOH、Na2CO3与盐酸反应分别生成NaCl和NaHCO3,即NaHCO3中加入酚酞后溶液不变色.而以甲基橙为指示剂时,NaOH、Na2CO3、NaHCO3与盐酸反应后均生成NaCl.现应用的双指示剂的方法,第一次和酚酞为指示剂,是将NaOH、Na2CO3分别转化为NaCl和NaHCO3;第二步以甲基橙为指示剂是将NaHCO3转化为NaCl,本题难度中等.

练习册系列答案
相关题目
下列描述中正确的是( )
| A、HCl和NaOH反应的中和热△H=-57.3kJ?mol-1,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ?mol-1 |
| B、CO(g)的燃烧热是283.0 kJ?mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0 kJ?mol-1 |
| C、牺牲阳极阴极保护法是应用电解原理防止金属的腐蚀 |
| D、用洁净玻璃棒蘸取某溶液点在湿润的pH试纸上,与标准比色卡对比即可测定该溶液pH |
下列有关实验操作的说法错误的是( )
| A、中和滴定时盛待测液的锥形瓶中有少量水对滴定结果无影响 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、滴定时,左手控制滴定管活塞,右手持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 |
| D、称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘 |
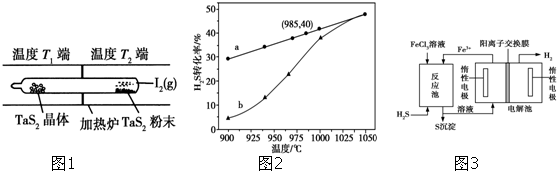
 碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法错误的是( )
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法错误的是( )| A、用KI淀粉试纸和食醋无法检验加碘盐中是否含有碘 |
| B、足量Cl2能使湿润的KI淀粉试纸变白的原因可能是:5Cl2+I2+6H2O→2HIO3+10HCl |
| C、由图可知氧化性的强弱顺序为Cl2>IO3->I2 |
| D、途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA |
确定下列置于空气中的物质是否变质,所选检测试剂(括号内为物质),不能达到目的是( )
| A、Na2SO3溶液(BaCl2溶液) |
| B、FeCl2溶液(KSCN溶液) |
| C、KI溶液(淀粉溶液) |
| D、氯水(品红溶液) |
下列实验误差分析错误的是( )
| A、用容量瓶配制溶液时,定容时仰视刻度线,所配溶液浓度偏小 |
| B、用润湿的pH试纸测溶液的pH,所测pH不一定有误差 |
| C、测定中和反应的反应热时,将碱分多次倒入酸中,所测△H偏小 |
| D、酸碱中和滴定时,滴定前盛装标准液的滴定管内有气泡,终点读数时气泡消失,所测结果偏大 |