题目内容
19.如图是s能级和p能级的原子轨道图,试回答下列问题:
(1)s电子的原子轨道呈球形,每个s能级有1个原子轨道;p电子的原子轨道呈纺锤形,每个p能级有3个原子轨道.
(2)元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是2p电子,其电子云在空间有三个互相垂直的伸展方向;元素X的名称是氮,它的氢化物的电子式是
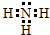 .若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的价电子排布图为
.若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的价电子排布图为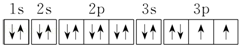 .
.(3)写出稳定铁离子的电子排布式1s22s22p63s23p63d5.
分析 (1)根据图片中轨道的形状进行分析解答,注意p能级有3个轨道;
(2)元素X的原子最外层电子排布式为nsnnpn+1,s能级最多排2个电子,该元素排列了p能级,说明s能级已经填满,所以n=2,则该元素最外层电子排布式为2s22p3,则该元素是N元素;
(3)写出稳定铁离子的电子排布式为1s2 2s2 2p6 3s23p63d5;
解答 解:(1)根据图片,s电子的原子轨道呈球形,含有1个原子轨道;p电子的原子轨道呈纺锤形,每个p能级有3个原子轨道,且这三个轨道相互垂直,
故答案为:球,1;纺锤,3;
(2)因为元素X的原子最外层电子排布式为nsnnn+1,np轨道已排上电子,说明ns轨道已排满电子,即n=2,则元素X的原子核外电子排布式为1s22s22p3,是氮元素,原子中能量最高的是2p电子,其电子云在空间有三个互相垂直的伸展方向,氢化物的电子式是 ;当元素X的原子最外层电子排布式为nsn-1npn+1时,有n-1=2,则n=3,则X元素的原子核外电子排布式为1s22s22p63s23p4,是硫元素,原子的电子排布图为
;当元素X的原子最外层电子排布式为nsn-1npn+1时,有n-1=2,则n=3,则X元素的原子核外电子排布式为1s22s22p63s23p4,是硫元素,原子的电子排布图为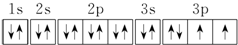 ;故答案为:2p; 三个互相垂直的伸展; 氮;
;故答案为:2p; 三个互相垂直的伸展; 氮;  ;S;
;S; ;
;
(3)写出稳定铁离子的电子排布式为1s2 2s2 2p6 3s23p63d5,故答案为:1s2 2s2 2p6 3s23p63d5.
点评 本题考查了原子核外电子排布及轨道伸展方向等知识点,正确推断元素是解本题关键,难度不大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
10.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| B. | 23g Na 与足量H2O反应完全后可生成NA个H2分子 | |
| C. | 标准状况下,22.4LN2和H2混合气中含NA个原子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去8 NA个电子 |
14.在t℃时,将a gNH3完全溶于水,得到VmL溶液,假设该溶液的密度为ρg/cm3,质量分数为w,其中含NH4+的物质的量为b mol.下列叙述中正确的是( )
| A. | 溶质的质量分数w=$\frac{1000a}{17V}$100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$ (mol/L) | |
| C. | 溶液中c(OH-)=$\frac{b}{V}$ (mol/L) | |
| D. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w |
4.通过该反应可制得ClO2:2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法不正确的是( )
| A. | H2C2O4在反应中作还原剂 | |
| B. | 该反应中氧化产物与还原产物的物质的量之比为1:1 | |
| C. | KClO3在反应中得到电子 | |
| D. | 1 molKClO3参加反应有2mol电子转移 |
9.下列实验操作或记录正确的是( )
| A. | 用盐酸滴定氢氧化钠溶液时向锥形瓶中量取25.00mL的氢氧化钠溶液 | |
| B. | 用量筒测得排水法收集制得的氢气体积为50.28 mL | |
| C. | 用两只250 mL的容量瓶配制0.1 mol•L-1 500 mL的NaOH溶液 | |
| D. | 用托盘天平称取2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g |


 ,反应类型为加聚反应.
,反应类型为加聚反应. .
.