题目内容
14.在t℃时,将a gNH3完全溶于水,得到VmL溶液,假设该溶液的密度为ρg/cm3,质量分数为w,其中含NH4+的物质的量为b mol.下列叙述中正确的是( )| A. | 溶质的质量分数w=$\frac{1000a}{17V}$100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$ (mol/L) | |
| C. | 溶液中c(OH-)=$\frac{b}{V}$ (mol/L) | |
| D. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w |
分析 A.根据m=ρV计算溶液的质量,氨水溶液溶质为氨气,根据溶质的质量分数=$\frac{m(溶质)}{m(溶液)}$×100%计算;
B.根据n=$\frac{m}{M}$计算a g NH3的物质的量,溶液体积为VmL,再根据c=$\frac{n}{V}$计算溶液的物质的量浓度;
C.根据溶液呈电中性,可知c(OH-)=c(H+)+c(NH4+),据此计算判断;
D.溶质氨气的质量不变,水的密度比氨水的密度大,等体积混合后溶液的质量大于原氨水的2倍,根据溶质的质量分数=$\frac{m(溶质)}{m(溶液)}$×100%判断.
解答 解:A.氨水溶液溶质为氨气,该溶液的密度为ρ g•cm-3,体积为VmL,所以溶液质量为ρVg,溶质氨气的质量为ag,溶质的质量分数ω=$\frac{ag}{ρVg}$×100%,故A错误;
B.a g NH3的物质的量为$\frac{ag}{17g/mol}$=$\frac{a}{17}$mol,溶液体积为VmL,所以溶液的物质的量浓度c=$\frac{\frac{a}{17}mol}{V×1{0}^{-3}L}$=$\frac{1000a}{17V}$mol/L,故B正确;
C.溶液中c(NH4+)=$\frac{bmol}{V×1{0}^{-3}L}$=$\frac{1000b}{V}$mol/L,根据溶液呈电中性,可知c(OH-)=c(H+)+c(NH4+),则溶液中c(OH-)=$\frac{1000b}{V}$mol/L+c(H+),故C错误;
D.水的密度比氨水的密度大,相等体积的氨水与水,水的质量大,等体积混合后溶液的质量大于原氨水的2倍,溶液中氨气的质量相同,根据溶质的质量分数=$\frac{m(溶质)}{m(溶液)}$×100%可知,等体积混合所得溶液溶质的质量分数小于0.5ω,故D错误.
故选:B.
点评 本题考查物质的量浓度、质量分数的有关计算,难度中等,注意氨水溶液中溶质以氨气计算,注意对公式的理解,C选项为易错点,学生容易忽略水电离产生的氢氧根离子.

| A. | 液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质 | |
| B. | 蔗糖、酒精在水溶液或熔化时均不导电,所以它们是非电解质 | |
| C. | 铜、石墨均导电,所以它们是电解质 | |
| D. | NH3、CO2的水溶液均导电,所以NH3、CO2均是电解质 |

(1)以Na、K、H、O、C、S、N中任意两种或三种元素组成合
适的物质(填化学式),分别填在下表②③的后面.
| 物质 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | ①HCl ②H2SO4(或HNO3、H2CO3) | ③NaOH(或KOH) ④Ba(OH)2 | ⑤Na2CO3 ⑥Na2SO4 | ⑦CO2 ⑧Na2O2 |
(3)⑧中氧元素的化合价是-1呼吸面具中用⑧作为O2来源的反应原理为(用化学方程式表示2Na2O2+2CO2=2Na2CO3+O2
(4)简述实验室检验⑦的方法是将气体通入澄清石灰水中,若变浑浊,即可说明是CO2
(5)若制取标准状况下的CO2气体11.2L需要4mol•L-1的盐酸250毫升.
| A. | NaNO3 | B. | FeCl2 | C. | NaHSO3 | D. | AgNO3 |
| A. | 生活中常用到的纯碱、酒精、食醋等,因都含有碳元素,所以都是有机物 | |
| B. | 有的钻戒中的钻石,是金刚石,因有正四面体的网状结构,所以硬度很大 | |
| C. | 由于啤酒中酒精含量不高,因此可以大量饮用,不会醉酒 | |
| D. | 我们用到的蔗糖、淀粉、纤维素,都是由C、H、O元素组成高分子化合物 |
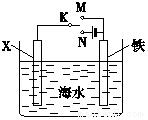 利用如图装置,可以模拟铁的电化学防护.
利用如图装置,可以模拟铁的电化学防护.
 .若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的价电子排布图为
.若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的价电子排布图为 .
.