题目内容
7.填空:同温同压下,相同体积的CO2和CO两种气体,它们的分子数之比1:1,所含的氧原子数之比2:1,它们的质量之比11:7,所含质子数之比11:7.分析 同温同压下,相同体积的CO2和CO两种气体的物质的量相等.根据N=nA计算分子数目之比,结合分子式计算氧原子数目之比,根据m=nM计算质量之比,CO2和CO分子含有质子数分别为22、14,进而计算质子数之比.
解答 解:同温同压下,相同体积的CO2和CO两种气体的物质的量相等.
根据N=nA可知,分子数目之比为1:1,结合分子式可知,氧原子数目之比为1×2:1×1=2:1,根据m=nM可知,二者质量之比为44g/mol:28g/mol=11:7,CO2和CO分子含有质子数分别为22、14,含有质子数之比为1×22:1×14=11:7,
故答案为:1:1;2:1;11:7;11:7.
点评 本题考查物质的量有关计算,注意对公式的理解与灵活应用,可以利用阿伏伽德罗定律及其推论判断同温同压下气体分子数目之比等于气体体积之比.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
15.将1.12g铁粉加入25mL 2mol/L的FeCl3溶液中,充分反应后,其结果是( )
| A. | 铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变 | |
| B. | 往溶液中滴入无色KSCN溶液,不显红色 | |
| C. | Fe2+和Fe3+物质的量之比为6:1 | |
| D. | 氧化产物和还原产物的物质的量之比为2:5 |
2.下列说法中正确的是( )
| A. | 液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质 | |
| B. | 蔗糖、酒精在水溶液或熔化时均不导电,所以它们是非电解质 | |
| C. | 铜、石墨均导电,所以它们是电解质 | |
| D. | NH3、CO2的水溶液均导电,所以NH3、CO2均是电解质 |
12.下列离子方程式书写正确的是( )
| A. | 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+6H+═3I2+3H2O | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ |
16. CO2气体中含有少量SO2,欲得到干燥纯净的CO2,通过下图所示的洗气瓶,(1)、(2)两瓶中所装的试剂应该是( )
CO2气体中含有少量SO2,欲得到干燥纯净的CO2,通过下图所示的洗气瓶,(1)、(2)两瓶中所装的试剂应该是( )
 CO2气体中含有少量SO2,欲得到干燥纯净的CO2,通过下图所示的洗气瓶,(1)、(2)两瓶中所装的试剂应该是( )
CO2气体中含有少量SO2,欲得到干燥纯净的CO2,通过下图所示的洗气瓶,(1)、(2)两瓶中所装的试剂应该是( )| A. | (1)NaOH (2)浓H2SO4 | B. | (1)浓H2SO4 (2)NaOH | ||
| C. | (1)饱和NaHCO3 (2)浓H2SO4 | D. | (1)浓H2SO4 (2)Na2CO3 |
17.下列有关说法正确的是( )
| A. | 加热分解NH4Cl固体可以制得NH3 | |
| B. | Fe2O3是碱性氧化物,常用作红色油漆和涂料 | |
| C. | 硅单质常用来制作光导纤维和太阳能电池 | |
| D. | 浓硫酸具有脱水性,可以干燥Cl2 |

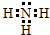 .若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的价电子排布图为
.若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的价电子排布图为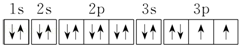 .
.