题目内容
10.NA为阿伏伽德罗常数的值.下列说法正确的是( )| A. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| B. | 23g Na 与足量H2O反应完全后可生成NA个H2分子 | |
| C. | 标准状况下,22.4LN2和H2混合气中含NA个原子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去8 NA个电子 |
分析 A.过氧化钠与水反应时,氧元素的价态一半由-1价变为0价,一半降为-2价;
B.依据钠与水反应方程式计算解答;
C.氮气与氢气都是双原子分子;
D.根据反应后铁元素变为+$\frac{8}{3}$价来分析;
解答 解:A.过氧化钠与水反应时,氧元素的价态由-1价变为0价,一半降为-2价,故当生成0.1mol氧气时转移0.2mol电子即0.2NA个,故A错误;
B.钠与水反应方程式:2Na+2H2O=2NaOH+H2↑,46g钠反应生成1mol水,所以23g Na 与足量H2O反应完全后可生成0.5NA个H2分子,故B错误;
C.标准状况下,22.4LN2和H2混合气中含2NA个原子,故C错误;
D.反应后铁元素变为+$\frac{8}{3}$价,故3mol铁失去8mol电子即8NA个,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,熟练掌握公式的运用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象.

练习册系列答案
相关题目
13.下列实验可获成功的是( )
| A. | 用乙烷和氯气等物质的量混合可以得到纯净的氯乙烷 | |
| B. | 将稀硫酸和无水酒精按3:1的体积比混合加热到170℃制取乙烯 | |
| C. | 将电石和饱和食盐水置于启普发生器中制取乙炔 | |
| D. | 用酸性KMnO4溶液可将己烷和己烯二种无色液体鉴别开来 |
1.2014年国家科学技术大会上,甲醇制取低碳烃技术(DMTO)获国家技术发明一等奖.DMTO主要包括煤的气化、液化、烯烃化三个阶段.
(1)煤的气化是煤在高温下转化为水煤气的过程,主要反应方程式是C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)煤的液化发生的主要反应如下表:
①△H1<△H2(填“>”、“<”、“=”),△H3=a+bkJ/mol(用a、b表示).
②若反应①在容积为2L的密闭容器中进行,500℃测得某一时刻体系内H2、CO、CH30H物质的量分别为4、2、10,则此时生成CH30H的速率>消耗CH30H的速率(填“>”、“<”、“=”)
③K3=2.5.
(3)烯烃化阶段:图1是烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比.图中I、II表示乙烯,III表示丙烯).
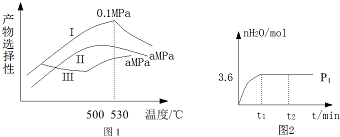
①根据图1,要尽可能多的获得乙烯,控制反应的最佳条件是530℃,0.1Mpa.
②一定温度下,某密闭容器发生如下反应:2CH3OH(g)=CH2=CH2(g)+2H2O(g),在压强为P1时,产物水的物质的量与时间的关系如图2所示,若t1时测得甲醇的体积分数是10%,此时甲醇乙烯化的转化率是85.7%(保留3位有效数字),若要提高甲醇的转化率,可采取的措施是降低压强、分离乙烯或水(写一条即可).
③若在t2时,将容器体积迅速扩大到原来的2倍,请图2中绘制出此变化发生后至反应达到新平衡时水的物质的量与时间的关系.
(1)煤的气化是煤在高温下转化为水煤气的过程,主要反应方程式是C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)煤的液化发生的主要反应如下表:
| 化学反应方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| ①2H2(g)+CO(g)=CH3OH(g)△H1=akJ/mol | 2.5 | 0.2 |
| ②H2(g)+CO2(g)=CO(g)+H2O(g)△H2=bkJ/mol | 1.0 | 2.3 |
| ③3H2(g)+CO2(g)=CH3OH(g)+H2O(g)△H3 | K3 | 4.6 |
②若反应①在容积为2L的密闭容器中进行,500℃测得某一时刻体系内H2、CO、CH30H物质的量分别为4、2、10,则此时生成CH30H的速率>消耗CH30H的速率(填“>”、“<”、“=”)
③K3=2.5.
(3)烯烃化阶段:图1是烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比.图中I、II表示乙烯,III表示丙烯).

①根据图1,要尽可能多的获得乙烯,控制反应的最佳条件是530℃,0.1Mpa.
②一定温度下,某密闭容器发生如下反应:2CH3OH(g)=CH2=CH2(g)+2H2O(g),在压强为P1时,产物水的物质的量与时间的关系如图2所示,若t1时测得甲醇的体积分数是10%,此时甲醇乙烯化的转化率是85.7%(保留3位有效数字),若要提高甲醇的转化率,可采取的措施是降低压强、分离乙烯或水(写一条即可).
③若在t2时,将容器体积迅速扩大到原来的2倍,请图2中绘制出此变化发生后至反应达到新平衡时水的物质的量与时间的关系.
15.将1.12g铁粉加入25mL 2mol/L的FeCl3溶液中,充分反应后,其结果是( )
| A. | 铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变 | |
| B. | 往溶液中滴入无色KSCN溶液,不显红色 | |
| C. | Fe2+和Fe3+物质的量之比为6:1 | |
| D. | 氧化产物和还原产物的物质的量之比为2:5 |
2.下列说法中正确的是( )
| A. | 液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质 | |
| B. | 蔗糖、酒精在水溶液或熔化时均不导电,所以它们是非电解质 | |
| C. | 铜、石墨均导电,所以它们是电解质 | |
| D. | NH3、CO2的水溶液均导电,所以NH3、CO2均是电解质 |
20.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 12.0g熔融的NaHSO4中含有的阳离子数为0.2NA | |
| B. | Na2O2与足量CO2反应生成2.24LO2,转移电子数为0.2NA | |
| C. | 4.6gNO2和N2O4混合物中含有的原子总数为0.3NA | |
| D. | 用惰性电极电解1L浓度均为2mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2NA个电子转移时,理论上阴极析出6.4g金属 |
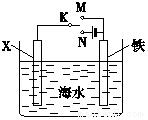 利用如图装置,可以模拟铁的电化学防护.
利用如图装置,可以模拟铁的电化学防护.
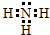 .若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的价电子排布图为
.若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的价电子排布图为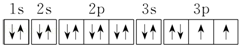 .
.