题目内容
2.氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业.CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化.以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下: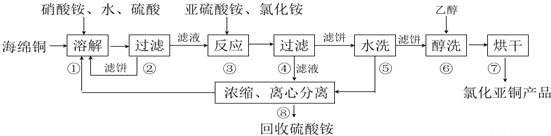
回答下列问题:
(1)步骤①溶解温度应控制在60~70度,原因是温度低溶解速度慢,温度过高铵盐分解,加入硝酸铵的作用是在酸性环境下有氧化性.
(2)写出步骤③中主要反应的离子方程式2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+.
(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是硫酸(写名称).
(4)上述工艺中,步骤⑥不能省略,理由是醇洗有利于加快去除CuCl表面水分防止其水解氧化.
(5)准确称取所制备的氯化亚铜样品m g,将其置于若两的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为$\frac{0.597ab}{m}$×100%.
分析 酸性条件下硝酸根离子具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜,过滤后在滤液中加入亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,得到的CuCl经硫酸酸洗,水洗后再用乙醇洗涤,可快速除去固体表面的水分,防止水解、氧化,步骤②、④、⑤、⑧都要进行固液分离,根据混合的水溶性进行分离,没有发生化学变化,可用离心机以及框式压滤机,以得到滤饼,氯化亚铜与氯化铁发生Fe3++CuCl═Fe2++Cu2++Cl-,加入K2Cr2O7溶液,发生6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,结合关系式解答该题.
解答 解:酸性条件下硝酸根离子具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜,过滤后在滤液中加入亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,得到的CuCl经硫酸酸洗,水洗后再用乙醇洗涤,烘干得到氯化亚铜.
(1)由于酸性条件下硝酸根离子具有氧化性,可氧化Cu生成CuSO4或Cu2+,溶解温度应控制在60-70℃,原因是温度低溶解速度慢,温度过高铵盐分解,硝酸铵在酸性环境下有氧化性,能氧化铜,生成铜离子,
故答案为:温度低溶解速度慢,温度过高铵盐分解;在酸性环境下有氧化性;
(2)铜离子与亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,
故答案为:2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+;
(3)由流程可知,经酸洗、水洗后得到硫酸铵,则应加入硫酸,为防止CuCl溶解,不能加入硝酸等氧化性酸,也不能加入盐酸,防止引入新杂质,
故答案为:硫酸;
(4)步骤⑥为醇洗,因乙醇沸点低,易挥发,则用乙醇洗涤,可快速除去固体表面的水分,防止水解、氧化,
故答案为:醇洗有利于加快去除CuCl表面水分防止其水解氧化;
(5)氯化亚铜与氯化铁发生Fe3++CuCl═Fe2++Cu2++Cl-,加入K2Cr2O7溶液,发生6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
反应的关系式为6CuCl~6Fe2+~Cr2O72-,
6 1
n ab×10-3mol
n=6ab×10-3mol,
m(CuCl)=99.5g/mol×6ab×10-3mol=0.597abg,
则样品中CuCl的质量分数为$\frac{0.597ab}{m}$×100%,
故答案为:$\frac{0.597ab}{m}$×100%.
点评 本题考查学生阅读获取信息的能力、常用化学用语、氧化还原滴定的应用等,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握物质的性质以及反应流程,难度中等,注意(5)中利用关系式的计算.


步骤1:充分反应后,过滤除去CaSO4沉淀.
步骤2:将葡萄糖酸溶液与ZnO混合.
(1)步骤2中,待其充分反应后,须继续加入葡萄糖酸溶液至pH为5.8,目的是抑制Zn2+的水解.
(2)下列物质可替代ZnO的是b、e(填字母).
a.NH3•H2O b.Zn(OH)2 c.NaOH d.ZnSO4e.ZnCO3.
Ⅱ.葡萄糖酸钙是一种可促进骨骼生长的营养物质.葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→(C6H11O7)2 Ca (葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
 请回答下列问题:
请回答下列问题:(3)第①步中溴水氧化葡萄糖可以用如图装置,其中水浴加热的原因是溶液受热均匀,且便于控制温度

(4)第②步中所加CaCO3还发生了其他反应,写出其中一个主要反应的方程式CaCO3+2HBr=CaBr2+CO2↑+H2O;
(5)第③步需趁热过滤,原因是葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品;第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出;
(6)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液.
| A. | 用乙烷和氯气等物质的量混合可以得到纯净的氯乙烷 | |
| B. | 将稀硫酸和无水酒精按3:1的体积比混合加热到170℃制取乙烯 | |
| C. | 将电石和饱和食盐水置于启普发生器中制取乙炔 | |
| D. | 用酸性KMnO4溶液可将己烷和己烯二种无色液体鉴别开来 |
(1)煤的气化是煤在高温下转化为水煤气的过程,主要反应方程式是C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)煤的液化发生的主要反应如下表:
| 化学反应方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| ①2H2(g)+CO(g)=CH3OH(g)△H1=akJ/mol | 2.5 | 0.2 |
| ②H2(g)+CO2(g)=CO(g)+H2O(g)△H2=bkJ/mol | 1.0 | 2.3 |
| ③3H2(g)+CO2(g)=CH3OH(g)+H2O(g)△H3 | K3 | 4.6 |
②若反应①在容积为2L的密闭容器中进行,500℃测得某一时刻体系内H2、CO、CH30H物质的量分别为4、2、10,则此时生成CH30H的速率>消耗CH30H的速率(填“>”、“<”、“=”)
③K3=2.5.
(3)烯烃化阶段:图1是烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比.图中I、II表示乙烯,III表示丙烯).
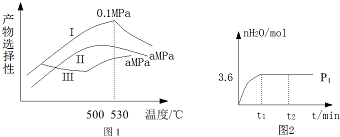
①根据图1,要尽可能多的获得乙烯,控制反应的最佳条件是530℃,0.1Mpa.
②一定温度下,某密闭容器发生如下反应:2CH3OH(g)=CH2=CH2(g)+2H2O(g),在压强为P1时,产物水的物质的量与时间的关系如图2所示,若t1时测得甲醇的体积分数是10%,此时甲醇乙烯化的转化率是85.7%(保留3位有效数字),若要提高甲醇的转化率,可采取的措施是降低压强、分离乙烯或水(写一条即可).
③若在t2时,将容器体积迅速扩大到原来的2倍,请图2中绘制出此变化发生后至反应达到新平衡时水的物质的量与时间的关系.
 现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入90mL浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.
现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入90mL浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.
 .若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的价电子排布图为
.若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的价电子排布图为 .
.