题目内容
16.下列热化学方程式表达正确的是(△H的绝对值均正确)( )| A. | C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) (△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)(△H=+57.3 kJ/mol (中和热) | |
| C. | S(s)+O2(g)=SO2(g) (△H=-269.8 kJ/mol (反应热) | |
| D. | 2NO2=O2+2NO (△H=+116.2 kJ/mol (反应热) |
分析 A.燃烧热中生成水为液态;
B.中和为放热反应;
C.燃烧为放热反应;
D.热化学方程式中应注明物质的状态.
解答 解:A.燃烧热方程式应为C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(l)△H=-1367.0 kJ/mol,故A错误;
B.中和热方程式应为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△H=-57.3 kJ/mol,故B错误;
C.热化学方程式为S(s)+O2(g)=SO2(g)△H=-269.8 kJ/mol,表示合理,故C正确;
D.热化学方程式应为2NO2(g)=O2(g)+2NO(g)△H=+116.2 kJ/mol,故D错误;
故选C.
点评 本题考查热化学方程式的书写,为高频考点,把握反应中能量变化、热化学方程式的书写方法、燃烧热与中和热为解答的关键,侧重分析与应用能力的考查,注意物质的状态、焓变的正负,题目难度不大.

练习册系列答案
相关题目
4.下列不能说明化学具有创造性和实用性的是( )
| A. | 化学家哈伯用催化法合成氨后,就能生产硝酸铵 | |
| B. | 化学家合成碳纳米管,用作分子导线和超小型电子器件 | |
| C. | 俄国科学家门捷列夫发现元素周期律 | |
| D. | 诺贝尔用硝化甘油制成了炸药,并用于工业生产 |
11.(l)由A、B、C、D四种金属按下表中装置进行实验.
根据实验现象回答下列问题:
①装置乙中正极的电极反应式是Cu2++2e-═Cu.
②四种金属活动性由强到弱的顺序是D>A>B>C.
(2)由Zn一Cu一硫酸溶液组成的原电池,工作一段时间后锌片的质量减少了6.5g.回答下列问题:溶液中的H+移向正极(填“正极”或“负极’).负极的电极反应式是Zn-2e-=Zn2+,标准状况下生成2.24L气体.
| 装置 | 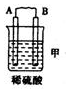 | 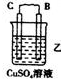 |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置乙中正极的电极反应式是Cu2++2e-═Cu.
②四种金属活动性由强到弱的顺序是D>A>B>C.
(2)由Zn一Cu一硫酸溶液组成的原电池,工作一段时间后锌片的质量减少了6.5g.回答下列问题:溶液中的H+移向正极(填“正极”或“负极’).负极的电极反应式是Zn-2e-=Zn2+,标准状况下生成2.24L气体.
1.下列说法中不正确的是( )
| A. | 1 mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L | |
| B. | 1 mol臭氧和1.5 mol氧气含有相同的氧原子数 | |
| C. | 标准状况下,22.4 L H2O的分子数为1NA | |
| D. | 等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1:6,氧原子数之比为1:3 |
8.某同学对铁的氧化物产生浓厚兴趣,查阅资料后得到以下信息:
在空气中把铁灼烧至500℃就形成Fe3O4;温度再升高,可形成Fe2O3;在更高的温度下加热Fe2O3(约1 400℃)时,可失去氧,又得到Fe3O4.即: 下列说法正确的是( )
下列说法正确的是( )
在空气中把铁灼烧至500℃就形成Fe3O4;温度再升高,可形成Fe2O3;在更高的温度下加热Fe2O3(约1 400℃)时,可失去氧,又得到Fe3O4.即:
 下列说法正确的是( )
下列说法正确的是( )| A. | FeO、Fe2O3和Fe3O4均为黑色固体 | |
| B. | 反应②③互为可逆反应 | |
| C. | 热稳定性顺序为:FeO>Fe2O3>Fe3O4 | |
| D. | 四氧化三铁中铁元素的化合价复杂,若写成氧化物的形式则化学式可写为FeO•Fe2O3,若视四氧化三铁为一种盐其化学式可写为Fe(FeO2)2 |
5.下列各物质中一定属于同系物的是( )
| A. | CH4和C2H4 | B. | 烷烃和环烷烃 | C. | C3H8和C5H12 | D. | C2H4和C4H8 |
6.下列关于物质性质变化的比较,不正确的是( )
| A. | 酸性强弱:HClO4>H2SO4>H3PO4>H2SiO3 | |
| B. | 原子半径大小:K>Na>S>O | |
| C. | 稳定性:NH3>PH3>AsH3 | |
| D. | 还原性强弱:F->Cl->Br |
 研究氧化物与悬浮在大气中的海盐粒子的相互作用时,设计如下反应:
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,设计如下反应: