题目内容
根据表中信息判断,下列选项不正确的是( )
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | KMnO4,HCl | Cl2、MnCl2… |
| A、第①组反应中,H2O2作还原剂 |
| B、第②组反应中,Cl2与FeBr2的物质的量之比为3:2 |
| C、第③组反应中,每生成1molCl2转移电子2mol |
| D、从三个反应可以得出:氧化性由强到弱顺序为MnO4->Fe3+>Cl2>Br2 |
考点:氧化还原反应
专题:
分析:A、反应中H2O2中氧元素化合价升高,作还原剂;
B、由元素化合价可知,反应中只有亚铁离子被氧化,结合电子转移守恒计算判断.
C、由信息可知,MnO4-氧化Cl-为Cl2,Cl元素化合价由-1价升高为0价,转移电子的物质的量是氯气的2倍.
D、氧化剂氧化性强于氧化产物氧化性,由②可知Fe3+不能氧化Br-,氧化性Br2>Fe3+.
B、由元素化合价可知,反应中只有亚铁离子被氧化,结合电子转移守恒计算判断.
C、由信息可知,MnO4-氧化Cl-为Cl2,Cl元素化合价由-1价升高为0价,转移电子的物质的量是氯气的2倍.
D、氧化剂氧化性强于氧化产物氧化性,由②可知Fe3+不能氧化Br-,氧化性Br2>Fe3+.
解答:
解:A、反应中KMnO4→MnSO4,Mn元素化合价由+7价降低为+2价,H2O2中氧元素化合价升高,生成氧气,所以H2O2作还原剂,故A正确;
B、由元素化合价可知,反应中只有亚铁离子被氧化,根据电子转移守恒2n(C12)=n(FeBr2),即n(C12):n(FeBr2)=1:2,故B错误;
C、由信息可知,MnO4-氧化Cl-为Cl2,Cl元素化合价由-1价升高为0价,转移电子的物质的量是氯气的2倍,生成1mo1C12,转移电子为2mo1,故C正确;
D、氧化剂氧化性强于氧化产物氧化性,由③可知氧化性MnO4->Cl2,由②可知氧化性Cl2>Fe3+,由②可知Fe3+不能氧化Br-,氧化性Br2>Fe3+,则氧化性由强到弱顺序为MnO4->Cl2>Br2>Fe3+,故D错误.
故选:BD.
B、由元素化合价可知,反应中只有亚铁离子被氧化,根据电子转移守恒2n(C12)=n(FeBr2),即n(C12):n(FeBr2)=1:2,故B错误;
C、由信息可知,MnO4-氧化Cl-为Cl2,Cl元素化合价由-1价升高为0价,转移电子的物质的量是氯气的2倍,生成1mo1C12,转移电子为2mo1,故C正确;
D、氧化剂氧化性强于氧化产物氧化性,由③可知氧化性MnO4->Cl2,由②可知氧化性Cl2>Fe3+,由②可知Fe3+不能氧化Br-,氧化性Br2>Fe3+,则氧化性由强到弱顺序为MnO4->Cl2>Br2>Fe3+,故D错误.
故选:BD.
点评:本题考查氧化还原反应的守恒与计算、氧化性与还原性强弱比较,难度中等,注意氧化还原反应中电子守恒的运用.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案
相关题目
下列离子在溶液中能大量共存的是( )
| A、Na+、CO32-、SO42-、H+ |
| B、K+、OH-、H+、Cl- |
| C、Mg2+、H+、NO3-、SO42- |
| D、Fe3+、K+、OH-、NO3- |
下列说法正确的是( )

| A、1mol白磷晶体中含有的P-P键的个数为4NA |
| B、12g金刚石中含有的C-C键的个数为1.5NA |
| C、12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
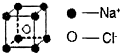
| D、1mol氯化钠(晶胞如图)中含有Na+数目为8NA |
下列各组物质中,属于醇类但不是同系物的是( )
| A、CH3OH和CH3CH2CH2OH |
| B、CH3COOH和C6H5CH2OH |
| C、CH3CH2OH和CH2=CHCH2OH |
| D、C6H5OH和C6H5CH2OH |
下列有关说法正确的是( )
| A、CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| B、电镀时常采用镀层金属作阳极,镀件作阴极 |
| C、复合肥(如磷酸氢二铵)和生石灰能一起施用 |
| D、水的离子积常数K,随着温度的升高而增大,说明水的电离是放热反应 |
下表中元素均为中学化学中常见短周期元素,根据表中信息,下列说法不正确的是( )
| 元素代号 | X | Y | Z | W | N |
| 原子半径/nm | 0.186 | 0.074 | 0.102 | 0.099 | 0.160 |
| 主要化合价 | +1 | -2 | -2、+6 | +7、-1 | +2 |
| A、X的最高价氧化物对应水化物的碱性比N的强 |
| B、由X、Y、Z三种元素只能组成一种含有离子键和共价键的化合物 |
| C、化台物X2Z的晶体类型与NW2的晶体类型相同 |
| D、由X和Y形成的一种淡黄色固体化合物中阴、阳离子个数比为1:2 |
已知:H2(g)+F2(g)═2HF(g)△H=-270kJ?mol-1,下列说法正确的是( )
| A、2 L氟化氢气体分解成1 L氢气与1 L氟气吸收270 kJ热量 |
| B、1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
| C、在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量 |
| D、1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量 |
下列说法正确的是( )
| A、SO2、SO3都是极性分子 |
| B、凡是中心原子采取sp3杂化轨道成键的分子其空间构型都是正四面体 |
| C、同周期ⅠA族元素和ⅦA族元素之间只能形成离子化合物 |
| D、干冰和氯化铵分别受热变为气体所克服的粒子间相互作用属于同种类型 |
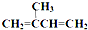 )为主要原料来进行的有机合成:
)为主要原料来进行的有机合成: