题目内容
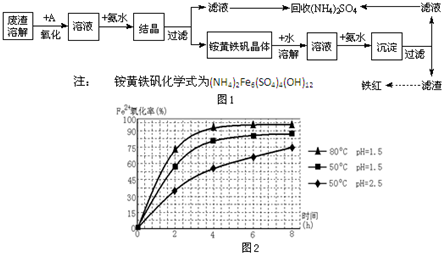 工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量MgO)制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,具体生产流程如图1:
工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量MgO)制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,具体生产流程如图1:(1)在废渣溶解操作时,应选用
A、氨水 B、氢氧化钠
C、盐酸 D、硫酸
(2)物质A是一种氧化剂,工业上最好选用
(3)根据图2有关数据,你认为工业上氧化操作时应控制的条件是:
A.溶液温度控制在50℃,pH控制在1.5,氧化时间为4小时左右
B.溶液温度控制在50℃,pH控制在1.5,氧化时间为6小时左右
C.溶液温度控制在50℃,pH控制在2.5,氧化时间为8小时左右
D.溶液温度控制在80℃,pH控制在1.5,氧化时间为4小时左右
(4)简述检验“滤液”中含有NH4+的实验方法:
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4:用硫酸溶解废渣,然后用空气中氧气氧化亚铁离子,加入氨水后结晶得到铵黄铁钒晶体,加水溶解后再加入氨水,反应生成氢氧化铁沉淀,加热氢氧化铁获得铁红,
(1)依据废渣成分结合提纯物质组成分析判断;
(2)氧化剂主要是用来氧化亚铁离子,空气来源丰富经济效益高不产生污染等回答;
(3)依据图象分析,亚铁离子的氧化率最高是溶液温度为80℃,pH为1.5;
(4)氨气能够使湿润的红色石蕊试纸变蓝,据此判断铵根离子的检验方法.
(1)依据废渣成分结合提纯物质组成分析判断;
(2)氧化剂主要是用来氧化亚铁离子,空气来源丰富经济效益高不产生污染等回答;
(3)依据图象分析,亚铁离子的氧化率最高是溶液温度为80℃,pH为1.5;
(4)氨气能够使湿润的红色石蕊试纸变蓝,据此判断铵根离子的检验方法.
解答:
解:根据制备流程可知:用硫酸溶解废渣,然后用空气中氧气氧化亚铁离子,加入氨水后结晶得到铵黄铁钒晶体,加水溶解后再加入氨水,反应生成氢氧化铁沉淀,加热氢氧化铁获得铁红,
(1)在废渣溶解操作时,目的是溶解氧化物,制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,不能引入杂质离子,
A.氨水不能溶解氧化物,能沉淀铁离子和亚铁离子,故A不选;
B.氢氧化钠溶液沉淀铁离子和亚铁离子不能溶解氧化钙、氧化镁,故B不选;
C.盐酸溶解氧化钙和氧化镁,但引入氯离子不能除去,故C不选;
D.硫酸能溶解氧化钙和氧化镁,且不引入杂质离子,故D选;
故答案为:D;
(2)氧化剂主要是氧化亚铁离子便于提取,氯气有毒且污染空气,引入了氯离子;二氧化锰是难溶于水的固体,空气来源丰富,成本低,不引入杂质,不产生污染,
故答案为:空气;原料来源容易,成本低,不产生污染,不引入杂质;
(3)分析图象可知在80℃时 溶液PH=1.5,此时亚铁离子的氧化率在90%以上,时间在4小时左右,所以D正确,
故答案为:D;
(4)检验铵根离子的方法为:取少量滤液于试管中,向试管中加入足量的浓氢氧化钠溶液,加热.用湿润的红色石蕊试纸放在试管口处,红色石蕊试纸变蓝色,说明滤液中含有NH4+,
故答案为:取少量滤液于试管中,向试管中加入足量的浓氢氧化钠溶液,加热.用湿润的红色石蕊试纸放在试管口处,红色石蕊试纸变蓝色,说明滤液中含有NH4+.
(1)在废渣溶解操作时,目的是溶解氧化物,制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,不能引入杂质离子,
A.氨水不能溶解氧化物,能沉淀铁离子和亚铁离子,故A不选;
B.氢氧化钠溶液沉淀铁离子和亚铁离子不能溶解氧化钙、氧化镁,故B不选;
C.盐酸溶解氧化钙和氧化镁,但引入氯离子不能除去,故C不选;
D.硫酸能溶解氧化钙和氧化镁,且不引入杂质离子,故D选;
故答案为:D;
(2)氧化剂主要是氧化亚铁离子便于提取,氯气有毒且污染空气,引入了氯离子;二氧化锰是难溶于水的固体,空气来源丰富,成本低,不引入杂质,不产生污染,
故答案为:空气;原料来源容易,成本低,不产生污染,不引入杂质;
(3)分析图象可知在80℃时 溶液PH=1.5,此时亚铁离子的氧化率在90%以上,时间在4小时左右,所以D正确,
故答案为:D;
(4)检验铵根离子的方法为:取少量滤液于试管中,向试管中加入足量的浓氢氧化钠溶液,加热.用湿润的红色石蕊试纸放在试管口处,红色石蕊试纸变蓝色,说明滤液中含有NH4+,
故答案为:取少量滤液于试管中,向试管中加入足量的浓氢氧化钠溶液,加热.用湿润的红色石蕊试纸放在试管口处,红色石蕊试纸变蓝色,说明滤液中含有NH4+.
点评:本题考查了物质制备、提纯、分离方法的综合应用,题目难度中等,本题要注意从实验目的和分离除杂原则考虑,如滤渣溶解时加硫酸而不加盐酸,因目的是回收(NH4)2SO4,结合题设去看流程,不必对流程每一步都弄清楚,如:如何生成黄铁钒、如何生成硫酸铵等,试题有利于培养学生的分析、理解能力及化学实验能力.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案
相关题目
对蛋白质与氨基酸的下列看法,正确的是( )
| A、蛋白质都难溶于水,所以需在蛋白酶的作用下水解,方可被人体吸收 |
| B、有些易溶于水的蛋白质,被人体摄入后,不需水解成氨基酸,就可被人体吸收 |
| C、在浓硫酸钠溶液中,鸡蛋白能析出,在浓盐酸中,猪肝蛋白会发生变性 |
| D、天然蛋白质水解产物都是α氨基酸,都只含1个羧基和1个氨基 |
将16mL NO和NH3的混合气体在催化剂作用下,400℃左右发生下列反应:6NO+4NH3?5N2+6H2O(g).已知反应达平衡后,在相同条件下混合气体的体积变为17mL,则在原混合气体中,NO和NH3的物质的量之比可能是 ( )
①3:1②3:2③3:3 ④3:4⑤3:5.
①3:1②3:2③3:3 ④3:4⑤3:5.
| A、①② | B、①⑤ | C、②③④ | D、④⑤ |
某化合物6.4g在氧气中完全燃烧,只生成8.8g CO2和7.2g H2O.下列说法正确的是( )
| A、该有机物属于烃 |
| B、该化合物中碳、氢原子个数比为1:4 |
| C、无法确定该化合物是否含有氧元素 |
| D、该化合物中一定不含有氧元素 |
工业制硝酸的其中一步反应为氨的氧化,反应方程式为:
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-1025kJ/mol氧化过程中还伴随有N2O、N2等物质生成.有关该反应的说法正确的是( )
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-1025kJ/mol氧化过程中还伴随有N2O、N2等物质生成.有关该反应的说法正确的是( )
| A、此反应物的总能量低于生成物的总能量 |
| B、反应达到平衡后,3ν正(NH3)=2ν逆(H2O) |
| C、其它条件不变,温度越高,氨的转化率越高 |
| D、寻找合适的催化剂是加快反应速率的有效措施 |

 如图中的实验装置可以用于实验室制取乙炔.请填空.
如图中的实验装置可以用于实验室制取乙炔.请填空.