题目内容
碱式氯化铝是某种高效净水剂的主要成分,实验室利用铝土矿(主要含Al2O3,还含少量Fe2O3及其他不溶杂质)制取碱式氯化铝的过程如下:

(1)溶解铝土矿需要使用质量分数为15%的盐酸,所需的玻璃仪器有: .
(2)盐酸溶解铝土矿过程中,发生反应的主要离子方程式为 ,其目的是 .
(3)从不引入杂质去考虑,调节溶液的pH时加入的物质最好为 (填序号).
A.NaOH B.Al C.氨水 D.Al2O3
(4)写出用pH试纸测定加入试剂X后所得溶液pH的操作:在白瓷板或玻璃片上放一小片pH试纸, ,得出被测液的pH.
(5)实验室利用浓HCl与大理石制取CO2的实验装置如图所示:

则各装置中导管的连接顺序的连接顺序为 ,装置C中盛放的试剂为 ,其作用是 .

(1)溶解铝土矿需要使用质量分数为15%的盐酸,所需的玻璃仪器有:
(2)盐酸溶解铝土矿过程中,发生反应的主要离子方程式为
(3)从不引入杂质去考虑,调节溶液的pH时加入的物质最好为
A.NaOH B.Al C.氨水 D.Al2O3
(4)写出用pH试纸测定加入试剂X后所得溶液pH的操作:在白瓷板或玻璃片上放一小片pH试纸,
(5)实验室利用浓HCl与大理石制取CO2的实验装置如图所示:

则各装置中导管的连接顺序的连接顺序为
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:铝土矿加盐酸溶解,发生反应为:Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O,再加铝粉消耗过量的盐酸生成三氯化铝,过滤得到氯化铁和三氯化铝溶液,加试剂X调节PH至5使氢氧化铁沉淀而除去,过滤得到纯的三氯化铝溶液,再蒸发浓缩得到产品,
(1)浓盐酸配20%的盐酸用到的仪器有:量筒、烧杯、玻璃棒;
(2)氧化铝 氧化铁属于碱性氧化物,均能和强酸之间反应生成对应的盐和水;目的将铝土矿中的Al2O3及Fe2O3转化为盐,与其他不溶杂质分离;
(3)从不引入杂质角度去考虑,根据选项判断能选择的试剂;
(4)根据用pH试纸测定加入试剂X后所得溶液pH的操作方法解答;
(5)根据制取的二氧化碳中含有氯化氢和水蒸气,应先通饱和NaHCO3溶液出氯化氢,再通过浓硫酸除水蒸气进行连接仪器并解答.
(1)浓盐酸配20%的盐酸用到的仪器有:量筒、烧杯、玻璃棒;
(2)氧化铝 氧化铁属于碱性氧化物,均能和强酸之间反应生成对应的盐和水;目的将铝土矿中的Al2O3及Fe2O3转化为盐,与其他不溶杂质分离;
(3)从不引入杂质角度去考虑,根据选项判断能选择的试剂;
(4)根据用pH试纸测定加入试剂X后所得溶液pH的操作方法解答;
(5)根据制取的二氧化碳中含有氯化氢和水蒸气,应先通饱和NaHCO3溶液出氯化氢,再通过浓硫酸除水蒸气进行连接仪器并解答.
解答:
解:铝土矿加盐酸溶解,发生反应为:Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O,再加铝粉消耗过量的盐酸生成三氯化铝,过滤得到氯化铁和三氯化铝溶液,加试剂X调节PH至5使氢氧化铁沉淀而除去,过滤得到纯的三氯化铝溶液,再蒸发浓缩得到产品,
(1)浓盐酸配20%的盐酸用到的仪器有:量筒、烧杯、玻璃棒,故答案为:量筒、烧杯、玻璃棒;
(2)氧化铝 氧化铁属于碱性氧化物,均能和强酸之间反应生成对应的盐和水,反应的方程式为:Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O,目的将铝土矿中的Al2O3及Fe2O3转化为盐,与其他不溶杂质分离;
故答案为:Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O;将铝土矿中的Al2O3及Fe2O3转化为盐,与其他不溶杂质分离;
(3)从不引入杂质角度去考虑,加入NaOH和氨水会引入钠离子和铵根离子,故选BD;
(4)用pH试纸测定加入试剂X后所得溶液pH的操作为在白瓷板或玻璃片上放一小片pH试纸,将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,得出被测液的pH,故答案为:将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较;
(5)因为制取的二氧化碳用浓盐酸与碳酸钙,所以制得的二氧化碳中含有氯化氢和水蒸气,应先通饱和NaHCO3溶液出氯化氢,再通过浓硫酸除水蒸气,所以装置中导管的连接顺序为acdfeb;装置C中盛放的试剂为 饱和NaHCO3溶液,作用是除去CO2中含有的HCl.
故答案为:acdfeb; 饱和NaHCO3溶液; 除去CO2中含有的HCl;
(1)浓盐酸配20%的盐酸用到的仪器有:量筒、烧杯、玻璃棒,故答案为:量筒、烧杯、玻璃棒;
(2)氧化铝 氧化铁属于碱性氧化物,均能和强酸之间反应生成对应的盐和水,反应的方程式为:Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O,目的将铝土矿中的Al2O3及Fe2O3转化为盐,与其他不溶杂质分离;
故答案为:Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O;将铝土矿中的Al2O3及Fe2O3转化为盐,与其他不溶杂质分离;
(3)从不引入杂质角度去考虑,加入NaOH和氨水会引入钠离子和铵根离子,故选BD;
(4)用pH试纸测定加入试剂X后所得溶液pH的操作为在白瓷板或玻璃片上放一小片pH试纸,将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,得出被测液的pH,故答案为:将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较;
(5)因为制取的二氧化碳用浓盐酸与碳酸钙,所以制得的二氧化碳中含有氯化氢和水蒸气,应先通饱和NaHCO3溶液出氯化氢,再通过浓硫酸除水蒸气,所以装置中导管的连接顺序为acdfeb;装置C中盛放的试剂为 饱和NaHCO3溶液,作用是除去CO2中含有的HCl.
故答案为:acdfeb; 饱和NaHCO3溶液; 除去CO2中含有的HCl;
点评:本题是一道考查物质的性质知识的工艺流程题目,要求学生具有分析和解决问题的能力,难度大,综合性强.

练习册系列答案
相关题目
某一化学反应在不同条件下的能量变化曲线如图所示.下列说法正确的是( )


| A、此反应放热,在任何条件下都能自发进行 |
| B、催化剂只改变反应历程,不影响热效应 |
| C、任何温度下,酶催化反应速率均比化学催化反应速率快 |
| D、酶催化的效果比化学催化效果好,能让反应放出更多热量 |
有甲基、苯基、羟基、羧基两两结合(包括自身)的物质中,具有酸性的有机物种类有( )
| A、3种 | B、4种 | C、5种 | D、6种 |


 (1)如图分别是温度计、量筒、滴定管的一部分,则:量筒应该是
(1)如图分别是温度计、量筒、滴定管的一部分,则:量筒应该是
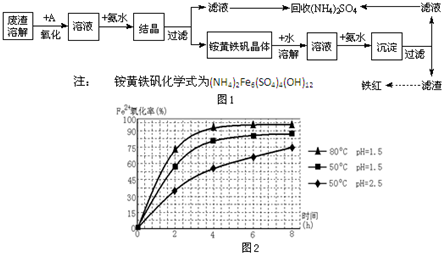 工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量MgO)制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,具体生产流程如图1:
工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量MgO)制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,具体生产流程如图1: