题目内容
19.常温下,下列溶液中的微粒浓度关系正确的是( )| A. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.4mol•L-1CH3COOH溶液与0.2mol•L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) |
分析 A.新制氯水中加入固体NaOH发生反应生成氯化钠、次氯酸钠和水,根据电荷守恒判断:c(Na+)+c(H+)=c(Cl-))+c(ClO-)+c(OH-);
B.pH=8.3的NaHCO3溶液,碳酸氢根离子水解溶液显碱性,碳酸氢根离子水解程度大于碳酸氢根离子的电离;
C.pH=11的氨水与pH=3的盐酸等体积混合,一水合氨又电离出氢氧根离子和铵根离子,溶液显碱性;
D.0.4mol•L-1CH3COOH溶液与0.2mol•L-1NaOH溶液等体积混合得到等浓度的CH3COOH和CH3COONa的混合溶液,依据溶液中电荷守恒和物料守恒计算分析判断.
解答 解:A.加入少量固体过氧化钠,反应后溶液中阴阳离子所带正负电荷总数相等,故存在c(H+)+c(Na+)=c(OH-)+c(Cl-)+c(ClO-),故A错误;
B.pH=8.3的NaHCO3溶液,碳酸氢根离子水解溶液显碱性,碳酸氢根离子水解程度大于碳酸氢根离子的电离,c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故B错误;
C.pH=11的氨水与pH=3的盐酸等体积混合,一水合氨又电离出氢氧根离子和铵根离子,溶液显碱性c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C错误;
D.混合得到等浓度的CH3COOH和CH3COONa的混合溶液,溶液中电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),2c(Na+)=c(CH3COO-)+c(CH3COOH),代入计算2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),故D正确;
故选D.
点评 本题考查了离子浓度大小、盐类水解、酸碱反应后溶液的酸碱性,主要是电解质溶液中电荷守恒、物料守恒等知识的理解应用,题目难度中等.

| A. | 用水鉴别乙醇、甲苯和硝基苯 | B. | 用燃烧法鉴别甲醇、苯和四氯化碳 | ||
| C. | 用酸性高锰酸钾溶液鉴别苯和甲苯 | D. | 用溴水鉴别乙苯、环己烷和乙醇 |
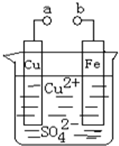
| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Fe-3e-=Fe3+ | |
| C. | a和b用导线连接时电子从Cu片流向铁片 | |
| D. | a和b用导线连接时,Cu2+向铜电极移动 |
| A. | 油脂、淀粉、蛋白质和维生素等均为高分子化合物 | |
| B. | 等质量的乙烷、乙烯、苯充分燃烧,消耗氧气的量由少到多 | |
| C. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理相同 | |
| D. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 |
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 4 | 2 | 0 | 0 | 放出热量:Q1 |
| 乙 | 3 | 1.5 | 1 | 0 | 放出热量:Q2 |
| 丙 | 3 | 1.5 | 1 | 0.1 | 放出热量:Q3 |
| A. | Q1=Q2=Q3=394 kJ | |
| B. | 若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ•mol-1 | |
| C. | 甲、乙、丙3个容器中反应的平衡常数不相等 | |
| D. | 达到平衡时,丙容器中SO2的体积分数最大 |
| A. | HOCH2CH2CHO | |
| B. | 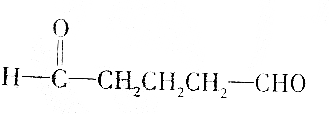 | |
| C. | 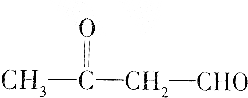 | |
| D. | 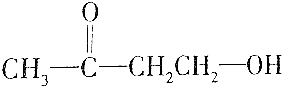 |
| A. | 对于C2H4(g)+H2O(g)?C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为1mol,则用分压表示的平衡常数kP=$\frac{3}{P}$ | |
| B. | 恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和C的物质的量分别为4nol、2mol和4mol,若此时A、B和C均增加1mol,平衡正向移动 | |
| C. | 恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)?2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡正向移动 | |
| D. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关 |
| A. | HX | B. | XH3 | C. | H2X | D. | XH4 |
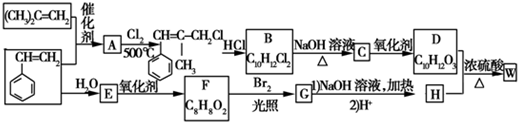
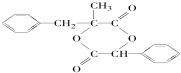 .
.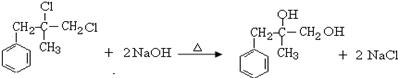 ;由D生成高分子化合物的方程式为
;由D生成高分子化合物的方程式为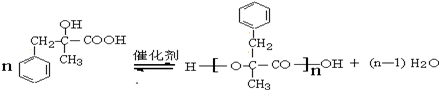 .
.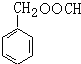 (写结构简式),其峰面积之比为1:2:2:2:1.
(写结构简式),其峰面积之比为1:2:2:2:1.