题目内容
4.一定条件下,可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算,分压=总压×物质的量分数.在恒温恒压条件下,总压不变,用平衡分压计算平衡常数更方便.下列说法不正确的是( )| A. | 对于C2H4(g)+H2O(g)?C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为1mol,则用分压表示的平衡常数kP=$\frac{3}{P}$ | |
| B. | 恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和C的物质的量分别为4nol、2mol和4mol,若此时A、B和C均增加1mol,平衡正向移动 | |
| C. | 恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)?2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡正向移动 | |
| D. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关 |
分析 A,分压=总压×物质的量分数,用分压表示的平衡常数kP=$\frac{{P}_{({C}_{2}{H}_{5}OH)}}{{P}_{({H}_{2}O)}•{P}_{({C}_{2}{H}_{4})}}$=$\frac{P•\frac{1}{3}}{P•\frac{1}{3}•P•\frac{1}{3}}$=$\frac{3}{P}$,故A,正确.
| B, | 考查等效平衡,恒温恒压下,在一容积可变的容器中,达到平衡时,A、B和C的物质的量分别为4nol、2mol和4mol,若此时A、B和C增加为4nol:2mol:4mol=2:1:2时,与原平衡一样,但此时A、B和C均增加1mol,拆成A、B和C的物质的量分别为1nol、0.5mol和1mol以及0.5molB.即在原平衡加0.5molB 平衡正向移动.故B,正确. |
| D, | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数只与温度有关,但用平衡分压表示的平衡常数是与温度和压强有关.故D,错误. |
解答 解:A,分压=总压×物质的量分数,用分压表示的平衡常数kP=$\frac{{P}_{({C}_{2}{H}_{5}OH)}}{{P}_{({H}_{2}O)}•{P}_{({C}_{2}{H}_{4})}}$=$\frac{P•\frac{1}{3}}{P•\frac{1}{3}•P•\frac{1}{3}}$=$\frac{3}{P}$,故A,正确.
| B, | 平衡正向移动.故B,正确. |
| D, | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数只与温度有关,但用平衡分压表示的平衡常数是与温度和压强有关.故D,错误. |
点评 考查恒温恒压下容积可变的等效平衡;用平衡分压表示的平衡常数的计算;用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数的区别.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
18.检验溴乙烷中含有溴元素存在的实验步骤、操作和顺序正确的是( )
①加入AgNO3溶液 ②加入NaOH溶液加热 ③加入适量HNO3 ④冷却.
①加入AgNO3溶液 ②加入NaOH溶液加热 ③加入适量HNO3 ④冷却.
| A. | ①②④③ | B. | ②④③① | C. | ②④① | D. | ③④① |
19.常温下,下列溶液中的微粒浓度关系正确的是( )
| A. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.4mol•L-1CH3COOH溶液与0.2mol•L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) |
16.已知:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(1)△H1,
2CO(g)+O2(g)=2CO2(g)△H2
2H2(g)+O2(g)=2H2O(1)△H3;
2H2(g)+O2(g)=2H2O(g)△H4
CO(g)+2H2(g)=CH3OH(g)△H5
下列关于上述反应焓变的判断正确的是( )
2CO(g)+O2(g)=2CO2(g)△H2
2H2(g)+O2(g)=2H2O(1)△H3;
2H2(g)+O2(g)=2H2O(g)△H4
CO(g)+2H2(g)=CH3OH(g)△H5
下列关于上述反应焓变的判断正确的是( )
| A. | △H1<0,△H2>0 | B. | 0>△H3>△H4 | ||
| C. | 2△H5+△H1>0 | D. | △H1=△H2+△H3-2△H5 |
13.①丙烯;②氯乙烯;③苯,三种有机化合物中,分子内所有原子均在同一平面的是( )
| A. | ①② | B. | ②③ | C. | ③ | D. | ② |
14.BHTCButylated Hydroxy Toluene)是一种常用的食品抗氧化剂,合成方法有如下两种:
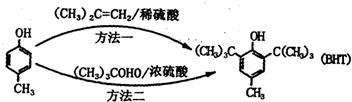
下列说法不正确的是( )

下列说法不正确的是( )
| A. | BHT在水中的溶解度小于苯酚 | |
| B. | 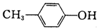 与BHT互为同系物 与BHT互为同系物 | |
| C. | 1molBHT可与含有2molBr2的浓溴水发生取代反应 | |
| D. | 方法一的原子利用率为100% |