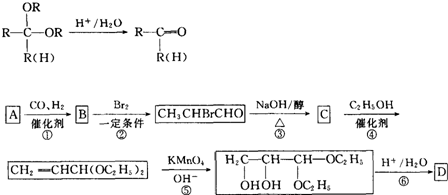
题目内容
某化学学习小组设计以下实验方案,测定某含有NaCl的小苏打样品中NaHCO3的质量分数.
[方案一]查资料:NaCl加热至801℃时熔化而不分解;称取一定质量样品,置于坩埚中用酒精灯加热至恒重后,冷却,称量剩余固体质量,计算.
(1)坩埚中发生反应的化学方程式为 ;
(2)实验中,需加热至恒重的目的是 .
[方案二]称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量澄清石灰水,过滤,洗涤、干燥沉淀,称量沉淀的质量,计算.
(1)检验沉淀是否完全的方法是
(2)有同学提出用Ba(OH)2溶液代替石灰水更好,其理由是
[方案三]准确称取1.000g样品,用容量瓶配成100mL溶液,用滴定管量取20.00mL移至锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定..4次实验的数据如下:
以下叙述正确的是(选填序号)
A.锥形瓶需要润洗
B.第4组的相对误差超过5%
C.样品中NaHCO3的质量分数为88.20%
D.造成第四组数据误差的原因可能是初读数仰视,末读数俯视.
[方案一]查资料:NaCl加热至801℃时熔化而不分解;称取一定质量样品,置于坩埚中用酒精灯加热至恒重后,冷却,称量剩余固体质量,计算.
(1)坩埚中发生反应的化学方程式为
(2)实验中,需加热至恒重的目的是
[方案二]称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量澄清石灰水,过滤,洗涤、干燥沉淀,称量沉淀的质量,计算.
(1)检验沉淀是否完全的方法是
(2)有同学提出用Ba(OH)2溶液代替石灰水更好,其理由是
[方案三]准确称取1.000g样品,用容量瓶配成100mL溶液,用滴定管量取20.00mL移至锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定..4次实验的数据如下:
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V (盐酸)/mL(初始) | 0.00 | 0.20 | 0.10 | 0.10 |
| V (盐酸)/mL(终点) | 20.98 | 21.22 | 21.10 | 21.12 |
A.锥形瓶需要润洗
B.第4组的相对误差超过5%
C.样品中NaHCO3的质量分数为88.20%
D.造成第四组数据误差的原因可能是初读数仰视,末读数俯视.
考点:探究物质的组成或测量物质的含量
专题:
分析:[方案一](1)坩埚中发生反应为碳酸氢钠受热分解生成碳酸钠、二氧化碳和水;
(2)需加热至恒重的目的是促使碳酸氢钠完全分解;
[方案二](1)检验沉淀是否完全的方法可以利用上层清液中加入氢氧化钙看是否生成白色沉淀分析设计;
(2)提出用Ba(OH)2溶液代替石灰水,式量更大,可以减少相对误差;
[方案三];4组体积变化误差大舍去,取1、2、3组实验数据计算平均值=
=21ml
A、锥形瓶不需待测夜润洗
B、第4组的相对误差=
;
C、NaHCO3+HCl=NaCl+H2O+CO2↑
20.00mL×c=21ml×0.1000mol/L
c=0.105mol/L
准确称取1.000g样品,用容量瓶配成100mL溶液中含有碳酸氢钠物质的量=0.105mol/L×0.1L=0.0105mol;依据碳酸氢钠质量计算质量分数;
D、初读数仰视,末读数俯视测定标准溶液体积减小.
(2)需加热至恒重的目的是促使碳酸氢钠完全分解;
[方案二](1)检验沉淀是否完全的方法可以利用上层清液中加入氢氧化钙看是否生成白色沉淀分析设计;
(2)提出用Ba(OH)2溶液代替石灰水,式量更大,可以减少相对误差;
[方案三];4组体积变化误差大舍去,取1、2、3组实验数据计算平均值=
| 20.98+21.22-0.2+21.10-0.10 |
| 3 |
A、锥形瓶不需待测夜润洗
B、第4组的相对误差=
| 21.02-21 |
| 21 |
C、NaHCO3+HCl=NaCl+H2O+CO2↑
20.00mL×c=21ml×0.1000mol/L
c=0.105mol/L
准确称取1.000g样品,用容量瓶配成100mL溶液中含有碳酸氢钠物质的量=0.105mol/L×0.1L=0.0105mol;依据碳酸氢钠质量计算质量分数;
D、初读数仰视,末读数俯视测定标准溶液体积减小.
解答:
解:[方案一](1)坩埚中发生反应为碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,反应的化学方程式为:2NaHCO3
Na2CO3+CO2↑+H2O;
故答案为:2NaHCO3
Na2CO3+CO2↑+H2O;
(2)需加热至恒重的目的是促使碳酸氢钠完全分解,故答案为:保证碳酸氢钠分解完全;
[方案二](1)检验沉淀是否完全的方法可以利用上层清液中加入氢氧化钙看是否生成白色沉淀分析设计,实验设计为:取少量上层清液少许于试管中,加一滴石灰水,观察是否有沉淀生成,若无沉淀生成,证明洗涤干净,
故答案为:取少量上层清液少许于试管中,加一滴石灰水,观察是否有沉淀生成;
(2)用Ba(OH)2溶液代替石灰水,式量更大,可以减少相对误差,
故答案为:式量更大,可以减少相对误差;
[方案三];4组体积变化误差大舍去,取1、2、3组实验数据计算平均值=
=21mL,
A、锥形瓶用水洗涤,不需待测夜润洗,故A错误;
B、第4组的相对误差=
×100%=0.01%,故B错误;
C、NaHCO3+HCl=NaCl+H2O+CO2↑
20.00mL×c=21ml×0.1000mol/L
c=0.105mol/L
准确称取1.000g样品,用容量瓶配成100mL溶液中含有碳酸氢钠物质的量=0.105mol/L×0.1L=0.0105mol
样品中NaHCO3的质量分数=
×100%=88.20%,故C正确;
D、初读数仰视,末读数俯视测定标准溶液体积减小,不符合4组的测定结果增大,故D错误;
故选C.
| ||
故答案为:2NaHCO3
| ||
(2)需加热至恒重的目的是促使碳酸氢钠完全分解,故答案为:保证碳酸氢钠分解完全;
[方案二](1)检验沉淀是否完全的方法可以利用上层清液中加入氢氧化钙看是否生成白色沉淀分析设计,实验设计为:取少量上层清液少许于试管中,加一滴石灰水,观察是否有沉淀生成,若无沉淀生成,证明洗涤干净,
故答案为:取少量上层清液少许于试管中,加一滴石灰水,观察是否有沉淀生成;
(2)用Ba(OH)2溶液代替石灰水,式量更大,可以减少相对误差,
故答案为:式量更大,可以减少相对误差;
[方案三];4组体积变化误差大舍去,取1、2、3组实验数据计算平均值=
| 20.98+21.22-0.2+21.10-0.10 |
| 3 |
A、锥形瓶用水洗涤,不需待测夜润洗,故A错误;
B、第4组的相对误差=
| 21.02-21 |
| 21 |
C、NaHCO3+HCl=NaCl+H2O+CO2↑
20.00mL×c=21ml×0.1000mol/L
c=0.105mol/L
准确称取1.000g样品,用容量瓶配成100mL溶液中含有碳酸氢钠物质的量=0.105mol/L×0.1L=0.0105mol
样品中NaHCO3的质量分数=
| 0.0105mol×84g/mol |
| 1.000g |
D、初读数仰视,末读数俯视测定标准溶液体积减小,不符合4组的测定结果增大,故D错误;
故选C.
点评:本题考查了实验探究物质组成和实验设计,过程分析判断,主要是滴定实验分析和计算的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在m A+n B═p C的反应中,m、n、p为各物质的计量数.现测得C每分钟增加a mol?L-1,B每分钟减少1.5a mol?L-1,A每分钟减少0.5a mol?L-1,则m:n:p为( )
| A、2:3:2 |
| B、2:3:3 |
| C、1:3:2 |
| D、3:1:2 |
下列实验操作或装置不符合实验要求的是( )
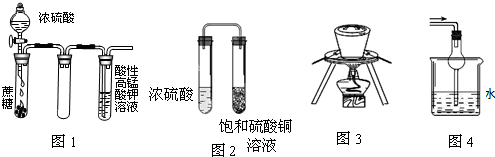

| A、图1酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去 |
| B、图2久置后,饱和硫酸铜溶液可能析出蓝色晶体 |
| C、图3在海带提碘实验中用于灼烧海带 |
| D、图4可用于吸收易溶于水的尾气 |
用标准浓度的盐酸滴定未知浓度的氢氧化钠溶液,测定结果,氢氧化钠溶液浓度值偏高,产生误差的原因可能是( )
| A、酸式滴定管用蒸馏水洗涤后,又用标准液润洗 |
| B、滴定过程中锥形瓶中振荡,有液体溅出 |
| C、滴定完毕,滴定管尖端外挂有液滴 |
| D、滴定前仰视读数,滴定终点俯视读数 |