题目内容
黄铜矿,辉铜矿,斑铜矿等是工业炼铜的常用原料.
(1)实验室以黄铜矿为原料模拟工业炼铜时会产生二氧化硫,用200mL 1mol/L的氢氧化钠溶液吸收后,将溶液低温蒸干,得到不含结晶水的固体19.98g,求所得固体的成分及物质的量.
(2)斑铜矿的主要成分M由Cu、Fe、S三种元素组成,其中Cu、Fe元素的质量比为40:7.常温下将5.04g M粉末全部溶于过量浓硝酸中,反应后的溶液加水稀释至500mL,测得其PH=0,向溶液中滴加5mol/L的氢氧化钠溶液,当加入126mL后,沉淀质量不在增加,求M的化学式.
(1)实验室以黄铜矿为原料模拟工业炼铜时会产生二氧化硫,用200mL 1mol/L的氢氧化钠溶液吸收后,将溶液低温蒸干,得到不含结晶水的固体19.98g,求所得固体的成分及物质的量.
(2)斑铜矿的主要成分M由Cu、Fe、S三种元素组成,其中Cu、Fe元素的质量比为40:7.常温下将5.04g M粉末全部溶于过量浓硝酸中,反应后的溶液加水稀释至500mL,测得其PH=0,向溶液中滴加5mol/L的氢氧化钠溶液,当加入126mL后,沉淀质量不在增加,求M的化学式.
考点:有关混合物反应的计算
专题:计算题
分析:(1)NaOH的物质的量为0.2L×1mol/L=0.2mol,假设固体全为Na2SO3,则生其质量为
×126g/mol=12.6g<19.98g,假设固体全是NaHSO3,则其质量为0.2mol×104g/mol=20.8>19.98g,故固体为Na2SO3、NaHSO3的混合物,根据钠离子守恒与二者总质量列方程计算各自物质的量;
(2)根据Cu、Fe元素的质量比为40:7计算n(Cu):n(Fe),当加水稀释至500 L时测得其pH为0,此是氢离子浓度为1mol/L,氢氧化钠先中和氢离子,然后将金属离子转化为沉淀,可知金属离子消耗氢氧化钠的物质的量为2n(Cu2+)+3n(Fe3+),联立可以计算n(Cu)、n(Fe),进而计算S元素物质的量,再计算三元素物质的量之比确定化学式.
| 0.2mol |
| 2 |
(2)根据Cu、Fe元素的质量比为40:7计算n(Cu):n(Fe),当加水稀释至500 L时测得其pH为0,此是氢离子浓度为1mol/L,氢氧化钠先中和氢离子,然后将金属离子转化为沉淀,可知金属离子消耗氢氧化钠的物质的量为2n(Cu2+)+3n(Fe3+),联立可以计算n(Cu)、n(Fe),进而计算S元素物质的量,再计算三元素物质的量之比确定化学式.
解答:
解:(1)NaOH的物质的量为0.2L×1mol/L=0.2mol,假设固体全为Na2SO3,则生其质量为
×126g/mol=12.6g<19.98g,假设固体全是NaHSO3,则其质量为0.2mol×104g/mol=20.8>19.98g,故固体为Na2SO3、NaHSO3的混合物,
设Na2SO3、NaHSO3的物质的量分别为xmol、ymol,则:
由二者总质量:126x+104y=19.98
根据Na元素守恒:2x+y=0.2
联立方程解得x=0.01,y=0.18,
答:所得固体中Na2SO3为0.01mol,NaHSO3为0.18mol;
(2)由Cu、Fe元素的质量比为40:7,则n(Cu):n(Fe)=
:
=5:1,当加水稀释至500 L时测得其pH为0,此是氢离子浓度为1mol/L,氢氧化钠先中和氢离子,然后将金属离子转化为沉淀,所以2n(Cu2+)+3n(Fe3+)=5mol/L×0.126L-1mol/L×0.5L=0.13mol,
联立解得:n(Cu)=0.05mol,n(Fe)=0.01mol,
故m(S)=5.04g-0.01mol×56g/mol-0.05mol×64g/mol=1.28g,则n(S)=
=0.04mol,
则n(Fe):n(Cu):n(S)=0.01mol:0.05mol:0.04mol=1:5:4,
则M的化学式为FeCu5S4,
答:M的化学式:FeCu5S4.
| 0.2mol |
| 2 |
设Na2SO3、NaHSO3的物质的量分别为xmol、ymol,则:
由二者总质量:126x+104y=19.98
根据Na元素守恒:2x+y=0.2
联立方程解得x=0.01,y=0.18,
答:所得固体中Na2SO3为0.01mol,NaHSO3为0.18mol;
(2)由Cu、Fe元素的质量比为40:7,则n(Cu):n(Fe)=
| 40 |
| 64 |
| 7 |
| 56 |
联立解得:n(Cu)=0.05mol,n(Fe)=0.01mol,
故m(S)=5.04g-0.01mol×56g/mol-0.05mol×64g/mol=1.28g,则n(S)=
| 1.28g |
| 32g/mol |
则n(Fe):n(Cu):n(S)=0.01mol:0.05mol:0.04mol=1:5:4,
则M的化学式为FeCu5S4,
答:M的化学式:FeCu5S4.
点评:本题考查混合物计算、复杂化学式的计算,侧重考查学生分析计算能力,注意极限法与守恒法的应用,难度中等.

练习册系列答案
相关题目
断肠草(Gelsemium)为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构简式,下列推断正确的是( )


| A、②中所含官能团种类比③中多 |
| B、①、④互为同系物 |
| C、①、②、③、④均能与氢氧化钠溶液反应 |
| D、等物质的量②、③分别在足量氧气中完全燃烧,前者消耗氧气比后者少 |
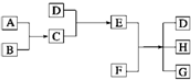 已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示:
已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示: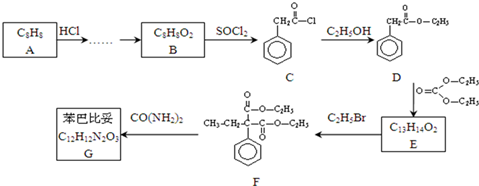



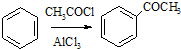 ,请设计合理方案以B的同系物
,请设计合理方案以B的同系物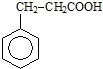 为原料合成
为原料合成 (用合成路线流程图表示为:A
(用合成路线流程图表示为:A