题目内容
18.下列实验操作正确的是( )| A. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol•L-1 | |
| B. | 100 g硫酸溶液的物质的量浓度为18.4 mol•L-1,用水稀释到物质的量浓度为9.2 mol•L-1,需要水100 g | |
| C. | 配制一定物质的量浓度的氯化钾溶液:准确称取一定质量的氯化钾固体,放入到1000 mL的容量瓶中,加水1000 mL溶解,振荡摇匀 | |
| D. | 将10 g CuSO4溶解在90 g水中,配制质量分数为10%的CuSO4溶液 |
分析 A、溶液的体积不等于水的体积;
B、稀释后溶液体积为浓硫酸体积2倍,由于浓硫酸的密度大于稀硫酸,故稀释后溶液质量小于200g,则加入水的质量小于100g;
C.不能在容量瓶中直接溶解固体样品;
D.利用质量分数计算式,计算所得溶液中溶质质量分数.
解答 解;A、溶液的体积不等于水的体积,所以含NA个Na+的Na2O溶解于1L水中形成溶液的体积不知道,无法计算其浓度,故A错误;
B、稀释后溶液体积为浓硫酸体积2倍,由于浓硫酸的密度大于稀硫酸,故稀释后溶液质量小于200g,则加入水的质量小于100g,故B错误;
C.容量瓶是用来配制一定物质的量浓度的溶液的定量仪器,只能在常温下使用,不能用来盛装过冷或过热的液体,不能在容量瓶中直接溶解固体样品,故C错误;
D.所得溶液中溶质的质量分数为$\frac{10g}{10g+90g}$×100%=10%,故D正确.
故选D.
点评 本题考查溶液的配制与计算,侧重于学生的分析能力和实验能力的考查,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.

练习册系列答案
相关题目
8.在恒温下的密闭容器中,有可逆反应2NO2?N2O4+热量,下列能说明反应达到了平衡状态的是( )
①NO2结合生成N2O4的速率与N2O4分解生成NO2速率相等时
②C(NO2)=C(N2O4)时
③N2O4 处于不再分解时
④NO2的分子数与N2O4 分子数比为2:1时
⑤体系颜色深浅不再发生改变时
⑥反应器中压强不再随时间变化时
⑦混合气体的平均分子量保持不变时
⑧混合气体的密度保持不变时.
①NO2结合生成N2O4的速率与N2O4分解生成NO2速率相等时
②C(NO2)=C(N2O4)时
③N2O4 处于不再分解时
④NO2的分子数与N2O4 分子数比为2:1时
⑤体系颜色深浅不再发生改变时
⑥反应器中压强不再随时间变化时
⑦混合气体的平均分子量保持不变时
⑧混合气体的密度保持不变时.
| A. | ①③⑤⑧ | B. | ②④⑥⑧ | C. | ③⑤⑦ | D. | ⑤⑥⑦ |
6.下列物质既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是( )
①SO2 ②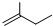 ③
③
④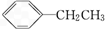 ⑤CH≡CCH3 ⑥CH3(CH2)4CH3.
⑤CH≡CCH3 ⑥CH3(CH2)4CH3.
①SO2 ②
 ③
③
④
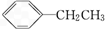 ⑤CH≡CCH3 ⑥CH3(CH2)4CH3.
⑤CH≡CCH3 ⑥CH3(CH2)4CH3.| A. | ①②③④ | B. | ③④⑤ | C. | ①②④⑥ | D. | ①②⑤ |
3.欲观察H2燃烧的火焰颜色,燃气导管口的材料最好是( )
| A. | 钠玻璃 | B. | 钾玻璃 | C. | 铜管 | D. | 石英玻璃 |
7.X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如表:
(1)W位于元素周期表第周四周期Ⅷ族期第族,其基态原子最外层有个电子2.
(2)X的电负性比Y的小(填“大”或“小”),XY2的价层电子对模型为直线型.
(3)X和Y的简单气态氢化物中,较稳定的是H2O,沸点较高的是(写化学式)H2O.
(4)化合物XYZ2中σ键和π键个数比为3:1.
(5)写出与W同周期且导电性强于W的某元素价电子排布式.3d104s1.
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z是第三周期电负性最大的元素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)X的电负性比Y的小(填“大”或“小”),XY2的价层电子对模型为直线型.
(3)X和Y的简单气态氢化物中,较稳定的是H2O,沸点较高的是(写化学式)H2O.
(4)化合物XYZ2中σ键和π键个数比为3:1.
(5)写出与W同周期且导电性强于W的某元素价电子排布式.3d104s1.
8.当稀硫酸与稀氢氧化钠溶液恰好完全中和时,一定相等的量是( )
| A. | 原溶液中,H2SO4和NaOH的质量 | B. | 原溶液中,H2SO4和NaOH的物质的量 | ||
| C. | 原溶液中,H+和OH-的物质的量 | D. | 原溶液中,H+和OH-的物质的量浓度 |
 .
. .
.