题目内容
8.在恒温下的密闭容器中,有可逆反应2NO2?N2O4+热量,下列能说明反应达到了平衡状态的是( )①NO2结合生成N2O4的速率与N2O4分解生成NO2速率相等时
②C(NO2)=C(N2O4)时
③N2O4 处于不再分解时
④NO2的分子数与N2O4 分子数比为2:1时
⑤体系颜色深浅不再发生改变时
⑥反应器中压强不再随时间变化时
⑦混合气体的平均分子量保持不变时
⑧混合气体的密度保持不变时.
| A. | ①③⑤⑧ | B. | ②④⑥⑧ | C. | ③⑤⑦ | D. | ⑤⑥⑦ |
分析 可逆反应2NO2?N2O4为气体体积缩小的反应,该反应达到化学平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断.
解答 解:①NO2生成N2O4的速率与N2O4分解生成NO2速率相等,反应速率之比与化学计量数之比不等,则正逆反应速率不等,说明此时没有达到平衡状态,故①错误;
②平衡时各物质的浓度关系取决于物质的起始物质的量和转化率,故c(NO2)=c(N2O4)时无法判断各组分的浓度是否继续变化,则不能说明反应达到平衡状态,故②错误;
③该反应为可逆反应,N2O4分解的同时也有N2O4的生成,不存在N2O4不再分解的情况,故③错误;
④平衡时各物质的分子数之比取决于物质的起始物质的量和转化率,故NO2的分子数与N2O4分子数比为2:1时不能说明反应达到平衡状态,故④错误;
⑤NO2为红棕色气体,N2O4为无色气体,则体系颜色深浅不再发生改变时,说明各组分的浓度不再变化,该反应已经达到平衡状态,故⑤正确;
⑥反应前后气体的体积不等,若反应器中压强不再随时间变化时能说明反应达到平衡状态,故⑥正确;
⑦平均分子量=$\frac{{m}_{总}}{{n}_{总}}$,反应前后气体总质量不变,而总物质的量发生变化,若混合气体的平均分子量保持不变时,能说明反应达到平衡状态,故⑦正确;
⑧ρ=$\frac{m}{V}$,气体的总质量不变,容器容积不变,则混合气体的密度始终不变,不能根据密度判断平衡状态,故⑧错误;
根据分析可知,能说明反应达到平衡状态的是⑤⑥⑦,
故选D.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,注意该反应中二氧化氮为有色气体,可根据反应前后气体颜色是否变化判断平衡状态.

①2H2(g)+O2(g)=2H2O(g)+Q1kJ;
②2H2(g)+O2(g)=2H2O(l)+Q2kJ;
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)+Q3kJ;
其中放出热量Q1、Q2、Q3的大小关系为( )
| A. | Q1=Q2=Q3 | B. | Q3<Q1<Q2 | C. | Q3<Q2<Q1 | D. | Q1<Q2<2Q3 |
| A. | 向溴水中通入适量的SO2:Br2+SO2+2H2O═2Br-+SO${\;}_{4}^{2-}$+4H+ | |
| B. | 用铜作电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 向明矾溶液中滴加过量氨水:Al3++4NH3•H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| D. | 向小苏打溶液中加少量Ba(OH)2溶液:HCO${\;}_{3}^{-}$+Ba2++OH-═BaCO3↓+H2O |
| A. | 沸点:戊烷>异丁烷>正丁烷>丙烷 | |
| B. | 密度:CCl4>CHCl3>H2O>苯 | |
| C. | 含氢量:甲烷>乙醇>乙烯>苯 | |
| D. | 等物质的量物质完全燃烧消耗O2量:环己烷>己烷>苯>葡萄糖 |
| A. | 乙醇→乙醛 | B. | 甲烷→CO2 | C. | 苯→硝基苯 | D. | 氯乙烯→聚氯乙烯 |
| A. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol•L-1 | |
| B. | 100 g硫酸溶液的物质的量浓度为18.4 mol•L-1,用水稀释到物质的量浓度为9.2 mol•L-1,需要水100 g | |
| C. | 配制一定物质的量浓度的氯化钾溶液:准确称取一定质量的氯化钾固体,放入到1000 mL的容量瓶中,加水1000 mL溶解,振荡摇匀 | |
| D. | 将10 g CuSO4溶解在90 g水中,配制质量分数为10%的CuSO4溶液 |
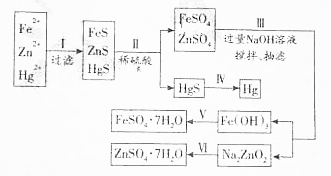
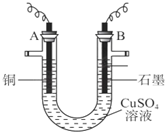
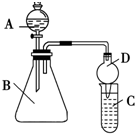 一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.
一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.