题目内容
3.欲观察H2燃烧的火焰颜色,燃气导管口的材料最好是( )| A. | 钠玻璃 | B. | 钾玻璃 | C. | 铜管 | D. | 石英玻璃 |
分析 观察H2燃烧的火焰颜色,应避免其它金属元素的焰色反应的干扰,以此解答该题.
解答 解:钠玻璃、钾玻璃、铜管,做氢气燃烧实验时,气体燃烧,燃气导管口中所含的金属钠(焰色反应为黄色)、钾(焰色反应隔着钴玻璃看是紫色)、铜(焰色反应为绿色)等产生的焰色反应会干扰观察氢气燃烧的火焰颜色,石英的成分是二氧化硅,在火焰下没有颜色,故最好选用石英玻璃.
故选D.
点评 本题考查了焰色反应的实质是元素的性质,为高频考点,侧重于学生的分析能力的考查,难度不大,掌握常见金属元素焰色反应的颜色是正确解答本题的关键.

练习册系列答案
相关题目
13.下列关系正确的是( )
| A. | 沸点:戊烷>异丁烷>正丁烷>丙烷 | |
| B. | 密度:CCl4>CHCl3>H2O>苯 | |
| C. | 含氢量:甲烷>乙醇>乙烯>苯 | |
| D. | 等物质的量物质完全燃烧消耗O2量:环己烷>己烷>苯>葡萄糖 |
11.下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是( )
| A. | SiO2和SO2 | B. | NaCl和HCl | C. | CO2和H2O | D. | CH4和KCl |
18.下列实验操作正确的是( )
| A. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol•L-1 | |
| B. | 100 g硫酸溶液的物质的量浓度为18.4 mol•L-1,用水稀释到物质的量浓度为9.2 mol•L-1,需要水100 g | |
| C. | 配制一定物质的量浓度的氯化钾溶液:准确称取一定质量的氯化钾固体,放入到1000 mL的容量瓶中,加水1000 mL溶解,振荡摇匀 | |
| D. | 将10 g CuSO4溶解在90 g水中,配制质量分数为10%的CuSO4溶液 |
15.开发新型储氢材料是氢能利用的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Ti3+的未成对电子数有1个.
②LiBH4由Li+和BH4-构成,BH4-的等电子体是NH4+(写一种).LiBH4中不存在的作用力有C(填标号).
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为_H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
M是Mg(填元素符号).
(3)某种新型储氧材料的理论结构模型如图1所示,图中虚线框内碳原子的杂化轨道类型有3种.
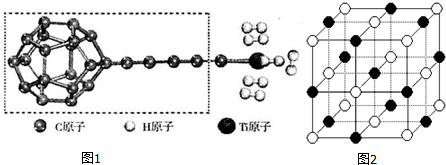
(4)若已知元素电负性氟大于氧,试解释沸点H2O高于HFH2O分子间氢键数比HF多,所以H2O沸点高.
分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料.X一定不是BC(填标号).
A.H2O B.CH4 C.HF D.CO(NH2)2
(5)图2中纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因.假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同.则这种纳米颗粒的表面粒子数占总粒子数的百分数为C.
A.87.5%B.92.9%
C.96.3%D.100%
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Ti3+的未成对电子数有1个.
②LiBH4由Li+和BH4-构成,BH4-的等电子体是NH4+(写一种).LiBH4中不存在的作用力有C(填标号).
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为_H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
| I1/KJ•mol-1 | I2/KJ•mol-1 | I3/KJ•mol-1 | I4/KJ•mol-1 | I5/KJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)某种新型储氧材料的理论结构模型如图1所示,图中虚线框内碳原子的杂化轨道类型有3种.

(4)若已知元素电负性氟大于氧,试解释沸点H2O高于HFH2O分子间氢键数比HF多,所以H2O沸点高.
分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料.X一定不是BC(填标号).
A.H2O B.CH4 C.HF D.CO(NH2)2
(5)图2中纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因.假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同.则这种纳米颗粒的表面粒子数占总粒子数的百分数为C.
A.87.5%B.92.9%
C.96.3%D.100%
12.短周期元素A、B、C,原子序数依次递增.已知:A、C同主族,而且三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )
| A. | 原子半径:A<C<B | |
| B. | 2.32g四氧化三铁与足量的B完全反应转移0.09mol电子 | |
| C. | C的气态氢化物无毒 | |
| D. | A元素在周期表中位于第二周期第VIA族 |
13.实验室可用如图所示的装置干燥、收集某气体R,则R可能是( )


| A. | SO2 | B. | NH3 | C. | CO2 | D. | Cl2 |
 随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示. .
.