题目内容
6.下列物质既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是( )①SO2 ②
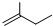 ③
③
④
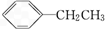 ⑤CH≡CCH3 ⑥CH3(CH2)4CH3.
⑤CH≡CCH3 ⑥CH3(CH2)4CH3.| A. | ①②③④ | B. | ③④⑤ | C. | ①②④⑥ | D. | ①②⑤ |
分析 能和溴水发生反应而使溴水褪色的物质含有碳碳不饱和键、醛基或具有强氧化性物质,能使酸性高锰酸钾溶液褪色的物质中含有碳碳不饱和键、醛基或连接苯环的碳原子上含有氢原子的苯的同系物或具有强还原性物质,据此分析解答.
解答 解:①SO2具有化学,能被酸性高锰酸钾溶液或溴水氧化而使酸性高锰酸钾溶液或溴水褪色,故正确;
② 中含有碳碳双键,能和溴发生加成反应而使溴水褪色,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故正确;
中含有碳碳双键,能和溴发生加成反应而使溴水褪色,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故正确;
③ 不能和溴水发生化学反应,但能萃取溴水中的溴而使溴水褪色,和酸性高锰酸钾溶液不反应,故错误;
不能和溴水发生化学反应,但能萃取溴水中的溴而使溴水褪色,和酸性高锰酸钾溶液不反应,故错误;
④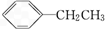 中连接苯环的碳原子上含有氢原子,所以能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,和溴水不反应,故错误;
中连接苯环的碳原子上含有氢原子,所以能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,和溴水不反应,故错误;
⑤CH≡CCH3中含有碳碳三键,能和溴发生加成反应而使溴水褪色,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故正确;
⑥CH3(CH2)4CH3为烷烃,性质较稳定,和溴水、酸性高锰酸钾溶液都不反应,所以不能使二者褪色,故错误;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,注意:只有连接苯环的碳原子上含有H原子的苯的同系物才能被酸性高锰酸钾溶液氧化,苯能使溴水褪色不是发生化学变化而发生物理变化.

练习册系列答案
相关题目
6.下列离子方程式正确的是( )
| A. | 向溴水中通入适量的SO2:Br2+SO2+2H2O═2Br-+SO${\;}_{4}^{2-}$+4H+ | |
| B. | 用铜作电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 向明矾溶液中滴加过量氨水:Al3++4NH3•H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| D. | 向小苏打溶液中加少量Ba(OH)2溶液:HCO${\;}_{3}^{-}$+Ba2++OH-═BaCO3↓+H2O |
17.下列变化,可以通过取代反应直接实现的是( )
| A. | 乙醇→乙醛 | B. | 甲烷→CO2 | C. | 苯→硝基苯 | D. | 氯乙烯→聚氯乙烯 |
11.下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是( )
| A. | SiO2和SO2 | B. | NaCl和HCl | C. | CO2和H2O | D. | CH4和KCl |
18.下列实验操作正确的是( )
| A. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol•L-1 | |
| B. | 100 g硫酸溶液的物质的量浓度为18.4 mol•L-1,用水稀释到物质的量浓度为9.2 mol•L-1,需要水100 g | |
| C. | 配制一定物质的量浓度的氯化钾溶液:准确称取一定质量的氯化钾固体,放入到1000 mL的容量瓶中,加水1000 mL溶解,振荡摇匀 | |
| D. | 将10 g CuSO4溶解在90 g水中,配制质量分数为10%的CuSO4溶液 |
15.开发新型储氢材料是氢能利用的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Ti3+的未成对电子数有1个.
②LiBH4由Li+和BH4-构成,BH4-的等电子体是NH4+(写一种).LiBH4中不存在的作用力有C(填标号).
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为_H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
M是Mg(填元素符号).
(3)某种新型储氧材料的理论结构模型如图1所示,图中虚线框内碳原子的杂化轨道类型有3种.

(4)若已知元素电负性氟大于氧,试解释沸点H2O高于HFH2O分子间氢键数比HF多,所以H2O沸点高.
分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料.X一定不是BC(填标号).
A.H2O B.CH4 C.HF D.CO(NH2)2
(5)图2中纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因.假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同.则这种纳米颗粒的表面粒子数占总粒子数的百分数为C.
A.87.5%B.92.9%
C.96.3%D.100%
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Ti3+的未成对电子数有1个.
②LiBH4由Li+和BH4-构成,BH4-的等电子体是NH4+(写一种).LiBH4中不存在的作用力有C(填标号).
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为_H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
| I1/KJ•mol-1 | I2/KJ•mol-1 | I3/KJ•mol-1 | I4/KJ•mol-1 | I5/KJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)某种新型储氧材料的理论结构模型如图1所示,图中虚线框内碳原子的杂化轨道类型有3种.

(4)若已知元素电负性氟大于氧,试解释沸点H2O高于HFH2O分子间氢键数比HF多,所以H2O沸点高.
分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料.X一定不是BC(填标号).
A.H2O B.CH4 C.HF D.CO(NH2)2
(5)图2中纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因.假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同.则这种纳米颗粒的表面粒子数占总粒子数的百分数为C.
A.87.5%B.92.9%
C.96.3%D.100%
16.下列说法不正确的是( )
| A. | 酸雨就是指pH<5.6的雨水 | |
| B. | 利用丁达尔效应可以区别溶液与胶体 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 将某气体通入品红溶液中,品红溶液褪色,则该气体一定是SO2 |
 随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示. .
.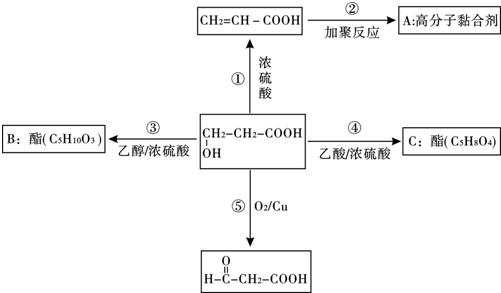
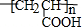 ,⑤2HOCH2CH2COOH+O2$→_{△}^{催化剂}$2OHCCH2COOH+2H2O.③的反应类型酯化反应或取代反应.
,⑤2HOCH2CH2COOH+O2$→_{△}^{催化剂}$2OHCCH2COOH+2H2O.③的反应类型酯化反应或取代反应.