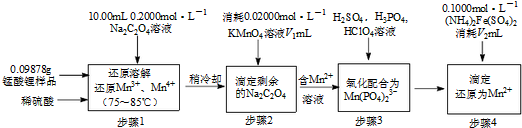
题目内容
18.将过量铁粉放入100mL3mol/L的HNO3溶液中,假设还原产物只有NO且HNO3完全反应,则参加反应的Fe的质量为( )| A. | 2.8g | B. | 6.3g | C. | 5.6g | D. | 11.2g |
分析 将过量铁粉放入100mL 3mol/L的HNO3溶液中,假设还原产物只有NO且HNO3完全反应,发生反应:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,根据方程式计算参加反应Fe的物质的量,再根据m=nM计算Fe的质量.
解答 解:100mL 3mol/L的HNO3溶液中含有0.1L×3mol/L=0.3mol,
3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O
3 8
n(Fe) 0.3mol
则n(Fe)=$\frac{0.3mol×3}{8}$=$\frac{0.9}{8}$mol,
故参加反应Fe的质量为$\frac{0.9}{8}$mol×56g/mol=6.3g,
故选:B.
点评 本题考查化学方程式有关计算,比较基础,注意Fe过量生成硝酸亚铁.

练习册系列答案
相关题目
8.实验室制Cl2的反应如下:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,下列有关该反应的说法正确的是( )
| A. | MnO2是还原剂 | B. | HCl被还原 | ||
| C. | MnO2发生氧化反应 | D. | 每反应4molHCl转移2mol电子 |
9.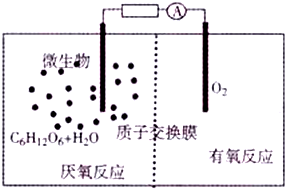 微生物电池是指在微生物的作用下将化学能转化为电能的装置(总反应方程式为C6H12O6+6O2═6CO2+6H2O),其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置(总反应方程式为C6H12O6+6O2═6CO2+6H2O),其工作原理如图所示.下列有关微生物电池的说法错误的是( )
 微生物电池是指在微生物的作用下将化学能转化为电能的装置(总反应方程式为C6H12O6+6O2═6CO2+6H2O),其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置(总反应方程式为C6H12O6+6O2═6CO2+6H2O),其工作原理如图所示.下列有关微生物电池的说法错误的是( )| A. | 正极区溶液的pH减小 | |
| B. | 微生物促进了反应中电子的转移 | |
| C. | 质子通过交换膜从负极区移向正极区6H2O+C6H12O6-24e-═6CO2+24H+ |
6.被誉为“光纤之父”的华人科学家高锟“在光学通信领域光在光纤中传输方面取得了开创性成就”.目前应用最广泛的无机光导纤维的主要原料为二氧化硅,下列关于二氧化硅的说法正确的是( )
| A. | SiO2溶于水生成的H2SiO3的酸性弱于H2CO3 | |
| B. | SiO2是一种空间立体网状结构的晶体,熔点高、硬度大 | |
| C. | 在SiO2晶体中,每个硅原子周围结合2个氧原子 | |
| D. | SiO2是一种酸性氧化物,所以不和任何酸反应 |
13.下列反应中符合H++OH-=H2O离子反应的是( )
| A. | 浓硝酸与氢氧化钡溶液 | B. | 稀硫酸与氢氧化钡溶液 | ||
| C. | 稀硫酸与稀氨水 | D. | 盐酸与氢氧化铁胶体反应 |
3.已知酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB-?H++B2-,则下列说法中一定正确的是( )
| A. | 在Na2B溶液中一定有:c(OH-)=c(H+)+c(HB-)+2c(H2B) | |
| B. | NaHB溶液可能存在以下关系:c(Na+)>c(HB-)>c(OH-)>c(H+) | |
| C. | NaHB水溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+c(B2-) | |
| D. | NaHB溶液一定呈酸性,Na2B溶液一定呈碱性 |
7.下列关于溶液中离子的说法正确的是( )
| A. | 0.2mol•L-1的Na2CO3溶液中离子浓度关系:c (Na+)=2c (CO32-)+c (HCO3-)+c (H2CO3) | |
| B. | 0.01mol•L-1的NH4Cl和0.01mol•L-1的NH3•H2O等体积混合后,若测得溶液中c (Cl-)>c (NH4+),则溶液中有关微粒的浓度关系: c (Cl-)>c (NH3•H2O)>c (NH4+)>c (H+)>c (OH-) | |
| C. | 0.1mol的NaHS和0.1mol的NaHSO4混合溶于水,配制成1L溶液,则混合溶液中离子浓度关系为:c (Na+)-0.1mol•L-1=2c (S2-)+c (H2S)+c (HS-) | |
| D. | 0.1mol•L-1的NaHCO3溶液中离子浓度关系:c (OH-)=c (H+)+c (H2CO3)-c (CO32-) |
12.检验溶液中的离子或物质,所用方法正确的是( )
| A. | 加入硝酸银溶液,有白色沉淀生成,证明一定有Cl-存在 | |
| B. | 加入BaCl2溶液和稀硝酸,有白色沉淀生成,证明一定有SO42- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ba2+ | |
| D. | 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ |