题目内容
1.用NA表示阿伏加德罗常数的值,下列叙述错误的是( )| A. | 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| B. | 60 g SiO2含有的化学键数目为4NA | |
| C. | CO2通过Na2O2使其增重a g时,反应中转移的电子数为aNA/56 | |
| D. | 常温常压下,14.9 g KCl与NaClO的固体混合物中阴离子的数目为0.2NA |
分析 A、将1 mol NH4NO3溶于稀氨水中使溶液呈中性,根据电荷守恒来分析;
B、求出二氧化硅的物质的量,然后根据1mol二氧化硅中含4mol硅氧键来分析;
C、过氧化钠和二氧化碳反应时,当1mol二氧化碳参与反应时,固体增重28g,转移1mol电子;
D、KCl与NaClO的摩尔质量均为74.5g/mol,且均有一个阴离子和一个阳离子构成.
解答 解:A、将1 mol NH4NO3溶于稀氨水中使溶液呈中性,根据电荷守恒可知:n(NH4+)+n(H+)=n(OH-)+n(NO3-),由于溶液显中性,故有n(H+)=n(OH-),则n(NH4+)=n(NO3-)=1mol,个数为NA个,故A正确;
B、60g二氧化硅的物质的量为1mol,而1mol二氧化硅中含4mol硅氧键,故含4NA个,故B正确;
C、过氧化钠和二氧化碳反应时,当1mol二氧化碳参与反应时,固体增重28g,转移1mol电子,设当增重ag时,转移的电子的物质的量为xmol,则有:$\frac{28}{a}=\frac{1}{x}$,解得x=$\frac{a}{28}$mol,个数为$\frac{a}{28}{N}_{A}$个,故C错误;
D、KCl与NaClO的摩尔质量均为74.5g/mol,故14.9g混合物的物质的量为0.2mol,且两者均有一个阴离子和一个阳离子构成,故0.2mol混合物中含0.2NA个阴离子,故D正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
11.下列各组离子在指定环境中能大量共存的是( )
| A. | 在c(CO32-)=0.1 mol•L-1的溶液中:K+、AlO2-、Cl-、NO3- | |
| B. | 在常温下由水电离出的c(OH-)=1×10-12 mol•L-1的溶液中:Fe2+、ClO-、Na+、SO42- | |
| C. | 在加入苯酚会显紫色的溶液中:NH4+、Cl-、Na+、SCN- | |
| D. | 在能使蓝色石蕊试纸变红的溶液中:S2O32-、CO32-、Na+、K+ |
12.2011年是国际化学年.中国的宣传口号是“化学--我们的生活.我们的未来”.下列有关叙不正确的是( )
| A. | 在家用燃煤中加人适量的生石灰能有效减少二氧化硫的排放量 | |
| B. | 利用太阳能、潮汐能、风力发电,以获取清洁能源 | |
| C. | 采用纳米二氧化钛光触媒技术.将汽车尾气中的NO和CO转化为无害气体 | |
| D. | 大量排放SO2,NO2或CO2都会导致酸雨的形成 |
9.在反应Cl2+KOH(浓热)→KClO3+KCl+H2O中,氧化剂与还原剂物质的量之比为( )
| A. | 1:1 | B. | 4:1 | C. | 1:4 | D. | 5:1 |
16.已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应).某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定.
步骤一:电解精制:
请回答以下问题:
电解时,阴极上的电极反应式为Cu2++2e=Cu;
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:3Ag+4H++NO3-=3Ag++NO↑+2H2O.
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1:3的混合物),请你简要解释金能够溶于王水的原因:浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的AuCl4-离子,使反应1平衡向右移动,则金溶于王水中
(2)滤液含量的测定:
以下是该小组探究滤液的一个实验流程:

则100ml滤液中Fe2+的浓度为0.1mol•L-1.
步骤一:电解精制:
请回答以下问题:
电解时,阴极上的电极反应式为Cu2++2e=Cu;
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:3Ag+4H++NO3-=3Ag++NO↑+2H2O.
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au+6HNO3(浓)═Au(NO3)3+3NO2↑+3H2O | <<1 |
| 2 | Au3++4Cl-═AuCl4- | >>1 |
(2)滤液含量的测定:
以下是该小组探究滤液的一个实验流程:

则100ml滤液中Fe2+的浓度为0.1mol•L-1.
13.下列有关实验原理或实验操作正确的是( )
| A. |  此图表示可用蒸馏法分离X、Y | B. |  SO2气体通入溴水中 | ||
| C. |  氨气通入醋酸溶液中 | D. | 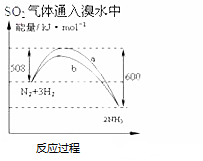 N2(g)+3H2(g)═2NH3(g)△H=-92KJmol |
10.下列说法正确的是( )
| A. | 在小苏打水溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| B. | 草酸氢钾溶液呈酸性,在0.1mol•L-1KHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| C. | 相同温度下,1 mol•L-1氨水溶液与0.5mol•L-1氨水溶液中,c(OH-)之比是2:1 | |
| D. | 当氨水与盐酸恰好完全反应时,c(NH4+)>c(Cl-)>c(H+)>c(OH-) |