题目内容
9.在反应Cl2+KOH(浓热)→KClO3+KCl+H2O中,氧化剂与还原剂物质的量之比为( )| A. | 1:1 | B. | 4:1 | C. | 1:4 | D. | 5:1 |
分析 反应的方程式为3Cl2+6KOH=5KCl+KClO3+3H2O,反应中Cl2自身发生氧化还原反应,生成KCl的反应为被还原的过程,Cl2为氧化剂,生成KClO3的为被还原的过程,Cl2为还原剂,以此解答该题.
解答 解:反应的方程式为3Cl2+6KOH=5KCl+KClO3+3H2O,Cl2自身发生氧化还原反应,生成KCl的反应为被还原的过程,Cl2为氧化剂,生成KClO3的为被还原的过程,Cl2为还原剂,
则如有3molCl2参加反应,氧化剂为2.5mol,还原剂为0.5mol,则氧化剂与还原剂的质量之比是2.5:0.5=5:1,
故选D.
点评 本题考查氧化还原反应的计算,题目难度不大,注意根据反应中元素化合价的变化判断氧化剂和还原剂等相关概念,结合反应的方程式进行计算.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
20.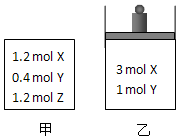 在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0.保持温度不变,测得平衡时的有关数据如表:下列说法正确的是( )
在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0.保持温度不变,测得平衡时的有关数据如表:下列说法正确的是( )
 在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0.保持温度不变,测得平衡时的有关数据如表:下列说法正确的是( )
在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0.保持温度不变,测得平衡时的有关数据如表:下列说法正确的是( ) | 恒容容器甲 | 恒压容器乙 | |
| X的物质的量(mol) | n1 | n2 |
| Z的体积分数 | φ1 | φ2 |
| A. | 平衡时容器乙的容积一定比反应前小 | |
| B. | 平衡时容器甲的压强一定比反应前小 | |
| C. | n2>n1 | |
| D. | φ2<φ1 |
17.强酸和强碱的稀溶液的中和热可表示为:H+(aq)+OH-(aq)═H2O(1);△H=-57.3kJ/mol.已知:
CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(1);△H=-Q1kJ/mol
$\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(1);△H=-Q2kJ/mol
HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(1);△H=-Q3kJ/mol
则Q1、Q2、Q3的关系正确的是( )
CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(1);△H=-Q1kJ/mol
$\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(1);△H=-Q2kJ/mol
HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(1);△H=-Q3kJ/mol
则Q1、Q2、Q3的关系正确的是( )
| A. | Q3>Q2>Q1 | B. | Q1>Q3>Q2 | C. | Q1=Q2=Q3 | D. | Q2>Q3>Q1 |
4.下列各项中表述错误的是( )
| A. | F的原子结构示意图: | |
| B. | CH3CH2COOH:从分类角度看该物质属于羧酸 | |
| C. | 次氯酸的电子式: | |
| D. | 壬烷和癸烷,丁烷和新戊烷均为同系物 |
1.用NA表示阿伏加德罗常数的值,下列叙述错误的是( )
| A. | 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| B. | 60 g SiO2含有的化学键数目为4NA | |
| C. | CO2通过Na2O2使其增重a g时,反应中转移的电子数为aNA/56 | |
| D. | 常温常压下,14.9 g KCl与NaClO的固体混合物中阴离子的数目为0.2NA |
18.(1)A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol•L-1.反应进行2min后A的浓度为0.8mol•L-1,B的浓度为0.6mol•L-1,C的浓度为0.6mol•L-1.则2min内反应的平均速v(A)=0.1mol/(Lmin).
(2)反应A+3B═2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15mol•L-1•s-1
②v(B)=0.6mol•L-1•s-1
③v(C)=0.4mol•L-1•s-1
④v(D)=0.45mol•L-1•s-1.
该反应进行的快慢顺序为④>②=③>①
(3)如表是稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题:
?实验4和5表明,固体反应物的表面积对反应速率有影响,表面积越大 反应速率越快,能表明同一规律的实验还有1和2(填实验序号);?本实验中影响反应速率的其他因素还有反应温度,其实验序号是6和7、8和9.
(2)反应A+3B═2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15mol•L-1•s-1
②v(B)=0.6mol•L-1•s-1
③v(C)=0.4mol•L-1•s-1
④v(D)=0.45mol•L-1•s-1.
该反应进行的快慢顺序为④>②=③>①
(3)如表是稀硫酸与某金属反应的实验数据:
| 实验序号 | 金属 质量/g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
?实验4和5表明,固体反应物的表面积对反应速率有影响,表面积越大 反应速率越快,能表明同一规律的实验还有1和2(填实验序号);?本实验中影响反应速率的其他因素还有反应温度,其实验序号是6和7、8和9.
 亚硝酸(HNO2)是一元弱酸,亚硝酸及其盐在实验和工业生产中有重要应用.请回答:
亚硝酸(HNO2)是一元弱酸,亚硝酸及其盐在实验和工业生产中有重要应用.请回答:
