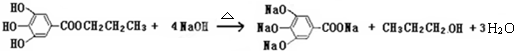题目内容
10.下列说法正确的是( )| A. | 在小苏打水溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| B. | 草酸氢钾溶液呈酸性,在0.1mol•L-1KHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| C. | 相同温度下,1 mol•L-1氨水溶液与0.5mol•L-1氨水溶液中,c(OH-)之比是2:1 | |
| D. | 当氨水与盐酸恰好完全反应时,c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
分析 A.溶液遵循电荷守恒;
B.草酸氢钾溶液呈酸性,可知HC2O4-的电离大于其水解;
C.弱电解质的浓度越小,电离程度越大;
D.氨水与盐酸恰好完全反应时,生成氯化铵,铵根离子水解显酸性.
解答 解:A.溶液遵循电荷守恒,则小苏打水溶液中存在:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故A错误;
B.草酸氢钾溶液呈酸性,可知HC2O4-的电离大于其水解,则0.1mol•L-1KHC2O4溶液中:c(C2O42-)>c(H2C2O4),故B正确;
C.弱电解质的浓度越小,电离程度越大,则相同温度下,1 mol•L-1氨水溶液与0.5mol•L-1氨水溶液中,c(OH-)之比小于2:1,故C错误;
D.氨水与盐酸恰好完全反应时,生成氯化铵,铵根离子水解显酸性,则离子浓度为c(Cl-)>c(NH4+)>c(H+)>c(OH-),故D错误;
故选B.
点评 本题考查离子浓度大小的比较,为高频考点,把握电离、水解及离子浓度的关系为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的难点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.用NA表示阿伏加德罗常数的值,下列叙述错误的是( )
| A. | 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| B. | 60 g SiO2含有的化学键数目为4NA | |
| C. | CO2通过Na2O2使其增重a g时,反应中转移的电子数为aNA/56 | |
| D. | 常温常压下,14.9 g KCl与NaClO的固体混合物中阴离子的数目为0.2NA |
1.已知丁烷有两种同分异构体,则分子式为C4H9Cl的有机物共有(不考虑立体异构)( )
| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |
5.下列不属于混合物的是( )
| A. | 液氯 | B. | 漂白粉 | C. | 盐酸 | D. | 碘酒 |
2.下列情况可引起大气污染的是( )
①煤的燃烧
②工业尾气的任意排放
③燃放鞭炮
④汽车尾气.
①煤的燃烧
②工业尾气的任意排放
③燃放鞭炮
④汽车尾气.
| A. | 只有①② | B. | 只有② | C. | 只有②④ | D. | ①②③④ |
19.光纤通信的光学纤维是由下列哪种物质经特殊工艺制成的( )
| A. | 碳 | B. | 二氧化硅 | C. | 铜 | D. | 硅 |

 (其中:-X、-Y均为官能团
(其中:-X、-Y均为官能团 .
.