��Ŀ����
6��ij�о����Ժ���������������ͭ�Ĺ�ҵ���Ͻ�����ص��о���ʵ�������ͼ1��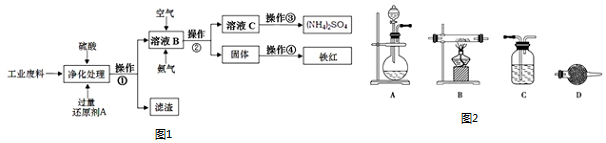
�ش��������⣺
��1�������ijɷ�ΪFe��Cu�������ٵ�����Ϊ���ˣ�
��2��ͼ1��ҺB����������Ӧ�����ӷ���ʽΪ4Fe2++O2+8NH3+10H2O=8NH4++4Fe��OH��3����
��3��ʵ��Ҫ������ҺB��ͨ������Ŀ�����֤��ͨ����������ķ�����ȡ�ϲ���Һ�������Թ��У��������Ը��������Һ�����Ը��������Һ����ɫ���䣨�ޱ仯����
��4�������۵�һ����Ҫ���������˾ƾ��ơ�����̨�⣬����Ҫ������������
��5��ijͬѧ����ͼ2װ���Ʊ�����������������ԭij�������������Ҫ��ش����⣮
�������һ��ʵ�鷽����֤H2�Ļ�ԭ�Բ����������������װ������˳����A��C��B��D��D����Dװ���⣬����װ�ò����ظ�ʹ�ã������Dװ��������ҩƷΪ��ʯ�ң��������Ƿ�ֹ������ˮ��������ǰ��װ���У�
�ڵ�ȼB���ƾ���֮ǰ������еIJ����Ǽ��������Ĵ��ȣ�
���� ����������������ͭ�Ĺ�ҵ���ϣ�������̿�֪��������ԭ���Լ�AΪFe���û���Cu���������Ϊ���ˣ�������ΪCu������Fe����ҺB����Ҫ������������ͨ������Ͱ�������Ӧ��������狀�����������������Ϊ���ˣ�����Ϊ����������������Ϊ���ȣ����ɺ�ɫ������������ҺCΪ�������Һ���������Ϊ�����ᾧ�õ�����茶��壬Ȼ����������ԭ����������ʱ����ͨ����������ȣ��Թ���ȴ����ֹͣͨ�����������
��� �⣺����������������ͭ�Ĺ�ҵ���ϣ�������̿�֪��������ԭ���Լ�AΪFe���û���Cu���������Ϊ���ˣ�������ΪCu������Fe����ҺB����Ҫ������������ͨ������Ͱ�������Ӧ��������狀�����������������Ϊ���ˣ�����Ϊ����������������Ϊ���ȣ����ɺ�ɫ������������ҺCΪ�������Һ���������Ϊ�����ᾧ�õ�����茶��壬
��1��������������֪������ΪFe��Cu��������Ϊ���ˣ�
�ʴ�Ϊ��Fe��Cu�����ˣ�
��2��B����������Ӧ�����ӷ���ʽΪ4Fe2++O2+8NH3+10H2O=8NH4++4Fe��OH��3����
�ʴ�Ϊ��4Fe2++O2+8NH3+10H2O=8NH4++4Fe��OH��3����
��3������ҺB��ͨ������Ŀ�����֤��ͨ��������������������Ӳ����ڣ��䷽����ȡ�ϲ���Һ�������Թ��У��������Ը��������Һ�����Ը��������Һ����ɫ���䣨�ޱ仯����
�ʴ�Ϊ��ȡ�ϲ���Һ�������Թ��У��������Ը��������Һ�����Ը��������Һ����ɫ���䣨�ޱ仯����
��4��������Ϊ�����ᾧ������Ҫ������Ϊ������������
�ʴ�Ϊ��������������
��5���ٸ�����֤H2�Ļ�ԭ�Բ��������������װ��˳������Ϊ��ȡ����װ��A����������װ��C����ԭ����������B�����黹ԭ����D�����տ����е�ˮ��װ��D������˳��Ϊ��A-C-B-D-D��Dװ��������ҩƷ��ʯ�ң�������Ϊ��ֹ������ˮ��������ǰ��װ���У�
�ʴ�Ϊ��C��B��D����ʯ�ң���ֹ������ˮ��������ǰ��װ���У�
��������Ϊ��ȼ�����壬��ȼ֮ǰӦ���������Ĵ��ȣ��ʴ�Ϊ�����������Ĵ��ȣ�
���� ���⿼�����ʵ����ʡ������ķ����ᴿ��ʵ�����̣����������з����ķ�Ӧ������Ϊ���Ĺؼ������ط���������֪ʶ�ۺ�Ӧ�������Ŀ��飬��Ŀ�Ѷ��еȣ�

 ������ҵ��ͬ����ϰ��ϵ�д�
������ҵ��ͬ����ϰ��ϵ�д�CH3COOH��aq��+NaOH��aq���TCH3COONa��aq��+H2O��1������H=-Q1kJ/mol
$\frac{1}{2}$H2SO4��Ũ��+NaOH��aq���T$\frac{1}{2}$Na2SO4��aq��+H2O��1������H=-Q2kJ/mol
HNO3��aq��+NaOH��aq���TNaNO3��aq��+H2O��1������H=-Q3kJ/mol
��Q1��Q2��Q3�Ĺ�ϵ��ȷ���ǣ�������
| A�� | Q3��Q2��Q1 | B�� | Q1��Q3��Q2 | C�� | Q1=Q2=Q3 | D�� | Q2��Q3��Q1 |
| A�� | ��1 mol NH4NO3����ϡ��ˮ��ʹ��Һ�����ԣ���Һ��NH4+��ĿΪNA | |
| B�� | 60 g SiO2���еĻ�ѧ����ĿΪ4NA | |
| C�� | CO2ͨ��Na2O2ʹ������a gʱ����Ӧ��ת�Ƶĵ�����ΪaNA/56 | |
| D�� | ���³�ѹ�£�14.9 g KCl��NaClO�Ĺ��������������ӵ���ĿΪ0.2NA |
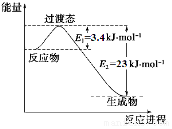 �о������ḻ��CO2��ȫ������Ϊ��̼Դ�������ǰӦ����㷺��̼Դ��ʯ�ͺ���Ȼ��������������Ҷ���ݽߵ�Σ����ͬʱ�ֿɻ�����CO2�ۻ�������������ЧӦ��ʵ��CO2������ѭ����
�о������ḻ��CO2��ȫ������Ϊ��̼Դ�������ǰӦ����㷺��̼Դ��ʯ�ͺ���Ȼ��������������Ҷ���ݽߵ�Σ����ͬʱ�ֿɻ�����CO2�ۻ�������������ЧӦ��ʵ��CO2������ѭ������1��Ŀǰ��ҵ����һ�ַ�������CO2��H2��230�����������ת�����ɼ״�������ˮ������ͼ��ʾ��ѹ������0.5mol CO2��1.5mol H2ת���ʴ�80%ʱ�������仯ʾ��ͼ��
��д���÷�Ӧ���Ȼ�ѧ����ʽ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49 kJ•mol-1��
�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������bd��
a��������ѹǿ����
b��H2�������������
c��c��H2��=3c��CH3OH��
d���������ܶȲ���
e��2��C=O���ѵ�ͬʱ��6��H-H���ѣ�
��2������ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�ӦCO��g��+H2O��g��?CO2��g��+H2��g�����õ�����������ݣ�
| ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
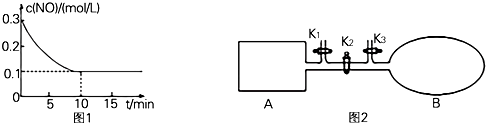
����ʵ��3�У���ƽ��ʱCOת���ʴ���ˮ����ת���ʣ���a/b ��ֵ0��$\frac{a}{b}$��1�������ֵ��Χ����
����ʵ��4�У�������990�棬�ڴ������м���CO��H2O��CO2��H2��Ϊ1mol�����ʱV����V�������������=��������
��3����֪�ڳ����£��״������ʵ����ȼ�ϣ�������ȼ�ϵ�أ�
����֪����2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��g����H1=-1275.6kJ•mol-1
��2CO��g��+O2��g���T2CO2��g����H2=-566.0kJ•mol-1
��H2O��g���TH2O��l����H3=-44.0kJ•mol-1
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽCH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442.8kJ/mol��
��4����֪������һ�ֶ�Ԫ�ᣬ����������Һ�����ԣ���������10Ml0.01mol/LH2C2O4��Һ�еμ�10mL0.01mol/LNaOH��Һʱ���Ƚ���Һ�и�������Ũ�ȴ�С��ϵc��Na+����c��HC2O4-����c��H+����c��C2O42-����c��OH-��
��5���Լ��ѿ�������������ҺΪԭ�ϣ�ʯīΪ�缫�ɹ���ȼ�ϵ�أ��õ�صĸ�����ӦʽΪCH3OCH3+16OH--12e-=2CO32-+11H2O��
��2����ӦA+3B�T2C+2D�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ��
��v��A��=0.15mol•L-1•s-1
��v��B��=0.6mol•L-1•s-1
��v��C��=0.4mol•L-1•s-1
��v��D��=0.45mol•L-1•s-1��
�÷�Ӧ���еĿ���˳��Ϊ�ܣ���=�ۣ���
��3�������ϡ������ij������Ӧ��ʵ�����ݣ�
| ʵ����� | ���� ����/g | ����״̬ | c��H2SO4�� /mol•L-1 | V��H2SO4�� /mL | ��Һ�¶�/�� | ������ʧ��ʱ��/s | |
| ��Ӧǰ | ��Ӧ�� | ||||||
| 1 | 0.10 | ˿ | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | ��ĩ | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | ˿ | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | ˿ | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | ��ĩ | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | ˿ | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | ˿ | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | ˿ | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | ˿ | 1.1 | 50 | 30 | 44 | 40 |
?ʵ��4��5���������巴Ӧ��ı�����Է�Ӧ������Ӱ�죬�����Խ�� ��Ӧ����Խ�죬�ܱ���ͬһ���ɵ�ʵ�黹��1��2����ʵ����ţ���?��ʵ����Ӱ�췴Ӧ���ʵ��������ػ��з�Ӧ�¶ȣ���ʵ�������6��7��8��9��



 �����У�-X��-Y��Ϊ������
�����У�-X��-Y��Ϊ������ ��
��