题目内容
13.下列有关实验原理或实验操作正确的是( )| A. |  此图表示可用蒸馏法分离X、Y | B. |  SO2气体通入溴水中 | ||
| C. |  氨气通入醋酸溶液中 | D. | 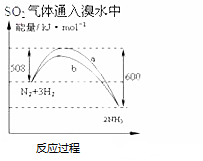 N2(g)+3H2(g)═2NH3(g)△H=-92KJmol |
分析 A.蒸馏法是利用物质熔沸点不同通过加热冷凝分离两种液体的方法;
B.溴水溶液中含有溴化氢,溴化氢为强酸,电离的产生氢离子,溶液显酸性;
C.氨气通入醋酸反应生成一水合氨,结合电解质导电强弱与自由移动离子浓度大小有关解答;
D.依据图示可知,反应物总能量高于生成物,反应放热,依据图示计算反应热,书写热化学方程式.
解答 解:A.依据图示可知,两种物质溶解度随着温度变化趋势不同,可以用降温结晶法分离,故A错误;
B.溴水溶液中含有溴化氢,溴化氢为强酸,电离的产生氢离子,溶液显酸性,所以开始溶液pH值应小于7,故B错误;
C.醋酸为弱酸,部分电离,通入氨气后反应生成醋酸铵,醋酸铵为强电解质,完全电离,产生自由移动离子浓度增大,所以导电能力增强,与图示不符,故C错误;
D.依据图示可知,反应物总能量高于生成物,反应放热,1mol氮气与3mol氢气完全反应生成2mol氨气,放出热量:600KJ-508KJ=92KJ,所以反应的热化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92KJmol,故D正确;
故选:D.
点评 本题为图象题,准确理解图象含义,熟悉常见分离物质方法及原理,明确电解质溶液导电性强弱原因,热化学方程式书写方法是解题关键,题目难度中等.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
4.下列各项中表述错误的是( )
| A. | F的原子结构示意图: | |
| B. | CH3CH2COOH:从分类角度看该物质属于羧酸 | |
| C. | 次氯酸的电子式: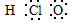 | |
| D. | 壬烷和癸烷,丁烷和新戊烷均为同系物 |
1.用NA表示阿伏加德罗常数的值,下列叙述错误的是( )
| A. | 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| B. | 60 g SiO2含有的化学键数目为4NA | |
| C. | CO2通过Na2O2使其增重a g时,反应中转移的电子数为aNA/56 | |
| D. | 常温常压下,14.9 g KCl与NaClO的固体混合物中阴离子的数目为0.2NA |
8.用排气法收集一瓶氨气,测得烧瓶内的气体在标况下的密度为0.893g/cm3,将烧瓶倒置于水中做喷泉实验,则液面上升的高度和所得溶液的摩尔浓度为( )
| A. | $\frac{1}{2}$、$\frac{1}{22.4}$ | B. | $\frac{1}{3}$、$\frac{1}{33.6}$ | C. | $\frac{2}{3}$、$\frac{1}{11.2}$ | D. | $\frac{3}{4}$、$\frac{1}{22.4}$ |
18.(1)A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol•L-1.反应进行2min后A的浓度为0.8mol•L-1,B的浓度为0.6mol•L-1,C的浓度为0.6mol•L-1.则2min内反应的平均速v(A)=0.1mol/(Lmin).
(2)反应A+3B═2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15mol•L-1•s-1
②v(B)=0.6mol•L-1•s-1
③v(C)=0.4mol•L-1•s-1
④v(D)=0.45mol•L-1•s-1.
该反应进行的快慢顺序为④>②=③>①
(3)如表是稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题:
?实验4和5表明,固体反应物的表面积对反应速率有影响,表面积越大 反应速率越快,能表明同一规律的实验还有1和2(填实验序号);?本实验中影响反应速率的其他因素还有反应温度,其实验序号是6和7、8和9.
(2)反应A+3B═2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15mol•L-1•s-1
②v(B)=0.6mol•L-1•s-1
③v(C)=0.4mol•L-1•s-1
④v(D)=0.45mol•L-1•s-1.
该反应进行的快慢顺序为④>②=③>①
(3)如表是稀硫酸与某金属反应的实验数据:
| 实验序号 | 金属 质量/g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
?实验4和5表明,固体反应物的表面积对反应速率有影响,表面积越大 反应速率越快,能表明同一规律的实验还有1和2(填实验序号);?本实验中影响反应速率的其他因素还有反应温度,其实验序号是6和7、8和9.
4.某同学拟用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜,流程如图所示:
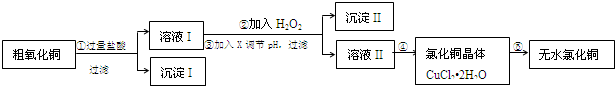
(1)步骤①中氧化铜与盐酸反应的离子方程式:CuO+2H+=Cu2++H2O.
(2)步骤②中加入H2O2的是为了将Fe2+氧化成Fe3+,Fe2+与H2O2在酸性溶液中反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)已知:
步骤③中调节pH的最佳范围为3.2-4.7,
步骤③中可以用于调节溶液pH的试剂X是bc:
a.NaOH b.CuO c. Cu(OH)2 d.NH3•H2O
(4)步骤⑤中要得到无水CuCl2,需要在干燥的HCl气流中加热CuCl2•2H2O,原因是在干燥的HCl气流中抑制Cu2+的水解,且带走CuCl2•xH2O受热产生的水气,故能得到无水氯化铜.

(1)步骤①中氧化铜与盐酸反应的离子方程式:CuO+2H+=Cu2++H2O.
(2)步骤②中加入H2O2的是为了将Fe2+氧化成Fe3+,Fe2+与H2O2在酸性溶液中反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7.0 | 9.0 |
步骤③中可以用于调节溶液pH的试剂X是bc:
a.NaOH b.CuO c. Cu(OH)2 d.NH3•H2O
(4)步骤⑤中要得到无水CuCl2,需要在干燥的HCl气流中加热CuCl2•2H2O,原因是在干燥的HCl气流中抑制Cu2+的水解,且带走CuCl2•xH2O受热产生的水气,故能得到无水氯化铜.
1.已知丁烷有两种同分异构体,则分子式为C4H9Cl的有机物共有(不考虑立体异构)( )
| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |
2.下列情况可引起大气污染的是( )
①煤的燃烧
②工业尾气的任意排放
③燃放鞭炮
④汽车尾气.
①煤的燃烧
②工业尾气的任意排放
③燃放鞭炮
④汽车尾气.
| A. | 只有①② | B. | 只有② | C. | 只有②④ | D. | ①②③④ |