题目内容
100mL 6mol/L H2SO4跟过量锌粉反应,恒温下,为减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量某物质或溶液,其中不能达到目的是( )
| A、醋酸钠(固体) |
| B、水 |
| C、硫酸钾溶液 |
| D、硫酸铵(固体) |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:根据反应的实质为Zn+2H+═Zn2++H2↑,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量即可,注意Zn过量,以此来解答.
解答:
解:A.加适量的醋酸钠,与酸反应,生成醋酸,氢离子的物质的量不变,浓度变小,则减缓反应进行的速率,但又不影响生成氢气的总量,能达到目的,故A错误;
B.加适量的水,相当于稀释,氢离子的物质的量不变,浓度变小,则减缓反应进行的速率,但又不影响生成氢气的总量,能达到目的,故B错误;
C.加适量的K2SO4溶液,相当于稀释,氢离子的物质的量不变,浓度变小,则减缓反应进行的速率,但又不影响生成氢气的总量,能达到目的,故C错误;
D.加适量的(NH4)2SO4(s),Zn与铵根离子水解生成的氢离子反应生成氢气,反应速率加快,氢气的量增大,故D正确;
故选D.
B.加适量的水,相当于稀释,氢离子的物质的量不变,浓度变小,则减缓反应进行的速率,但又不影响生成氢气的总量,能达到目的,故B错误;
C.加适量的K2SO4溶液,相当于稀释,氢离子的物质的量不变,浓度变小,则减缓反应进行的速率,但又不影响生成氢气的总量,能达到目的,故C错误;
D.加适量的(NH4)2SO4(s),Zn与铵根离子水解生成的氢离子反应生成氢气,反应速率加快,氢气的量增大,故D正确;
故选D.
点评:本题考查影响化学反应速率的因素,明确浓度对反应速率的影响即可解答,选项D为学生解答中的难点,注意D中水解生成氢离子,题目难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
下列说法正确的是( )
| A、pH<7的溶液一定呈酸性 |
| B、0.1mol/LKOH溶液和0.1mol/L氨水中,其c(OH-)相等 |
| C、pH为1的盐酸的c(H+)是pH为3的盐酸的100倍 |
| D、Na2 CO3溶液中,c(Na+)是c(CO32-)的两倍 |
采用循环操作可以提高原料的利用率,下列工业生产中,没有采用循环操作的是( )
| A、硫酸工业 | B、氯碱工业 |
| C、硝酸工业 | D、合成氨工业 |
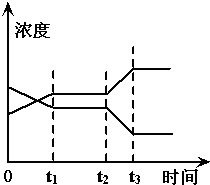 现有反应X(g)+Y(g)?2Z(g),△H>0.右图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3 s时又达平衡.则在图中t2 s时改变的条件可能是( )
现有反应X(g)+Y(g)?2Z(g),△H>0.右图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3 s时又达平衡.则在图中t2 s时改变的条件可能是( )| A、增大压强 |
| B、使用了催化剂 |
| C、升高温度 |
| D、减小了X或Y的浓度 |
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2→H2O Cl2→Cl-MnO4-→Mn2+ HNO3→NO,如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
| A、H2O2 |
| B、Cl2 |
| C、MnO4- |
| D、HNO3 |
LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车.电池反应为:FePO4+Li
LiFePO4,含Li+导电固体为电解质.下列有关LiFePO4电池说法不正确的是( )
| 放电 |
| 充电 |
| A、可加入硫酸以提高电解质的导电性 |
| B、充电时LiFePO4既发生氧化反应又发生还原反应 |
| C、充电过程中,电池正极材料的质量减少 |
| D、放电时电池正极反应为:FePO4+Li++e-═LiFePO4 |
下列有关说法正确的是( )
| A、煮沸饱和的FeCl3溶液能得到红褐色的氯化铁胶体 |
| B、根据化合物在水溶液或熔融状态下是否导电,将化合物分为电解质和非电解质 |
| C、能与碱反应生成盐和水的化合物称为酸性氧化物 |
| D、溶液与胶体的本质区别是能否发生丁达尔现象 |