题目内容
1. 铜锌原电池(如图)工作时
铜锌原电池(如图)工作时(1)正极反应为Cu2++2e-=Cu.
(2)电池反应为Zn+Cu2+═Zn2++Cu.
(3)盐桥中的Cl-移向ZnSO4溶液.
分析 活泼性强的金属作负极,发生失电子的氧化反应;活泼性弱的作正极,正极上溶液中的阳离子得电子的还原反应,溶液中阴离子向负极移动,据此分析.
解答 解:(1)锌、铜原电池中,活泼性强的金属Zn作负极,发生氧化反应:Zn-2e-=Zn2+,活泼性弱的Cu作正极,正极上铜离子发生还原反应:Cu2++2e-=Cu,
故答案为:Cu2++2e-=Cu;
(2)电池中的总反应为Zn+Cu2+═Zn2++Cu;
故答案为:Zn+Cu2+═Zn2++Cu;
(3)原电池放电时,溶液中阴离子向负极移动,则Cl-移向ZnSO4溶液移动;
故答案为:Cl-.
点评 本题考查了原电池的相关知识,注意原电池的形成条件、电子守恒、电极方程式的书写、以及正负极的判断,题目难度不大,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
11.在硫酸铜饱和溶液中,投入不规则的硫酸铜晶体,下列说法正确的是( )
| A. | 晶体形状不变 | B. | 晶体溶解,溶液的浓度变大 | ||
| C. | 晶体不溶解,溶液浓度不变 | D. | 晶体形状改变,溶液浓度不变 |
12.25℃时,弱酸的电离平衡常数如表,下列说法正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| K | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 等物质的量浓度溶液pH关系:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | amol/L HCN与bmol/L NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b | |
| C. | 往冰醋酸中逐滴加水,溶液导电能力先增大,后减小 | |
| D. | NaHCO3和Na2CO3的混合液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
9.短周期主族元素X、Y、Z、W的原子序数依次增大,X元素原子最外层电子数是内层的2倍,Z是地壳中含量最高的元素,W是同周期原子半径最大的金属元素.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| B. | X的最高价氧化物对应水化物的酸性比Y的强 | |
| C. | Z的简单气态氢化物的热稳定性比Y的强 | |
| D. | Z分别与X、W形成的化合物的化学键类型相同 |
16.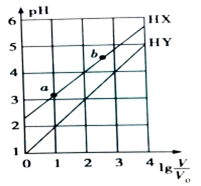 常温下,浓度均为0.1mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示(不考虑HX、HY和H2O的挥发),下列叙述正确的是( )
常温下,浓度均为0.1mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示(不考虑HX、HY和H2O的挥发),下列叙述正确的是( )
 常温下,浓度均为0.1mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示(不考虑HX、HY和H2O的挥发),下列叙述正确的是( )
常温下,浓度均为0.1mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示(不考虑HX、HY和H2O的挥发),下列叙述正确的是( )| A. | HX和HY都是弱酸,且HX的酸性比HY的弱 | |
| B. | HX的电离程度:a点大于b点 | |
| C. | HX溶液由a点稀释至b点时,由水电离出的c(H+)•c(OH-)不变 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=3时,若两溶液同时升高温度,则$\frac{c({X}^{-})}{c({Y}^{-})}$增大 |
13.将一小块金属钠投入到下列溶液中,既能产生气体又会出现沉淀的是( )
| A. | 稀硫酸 | B. | 碳酸氢钠溶液 | C. | 硫酸铁溶液 | D. | 氯化钠溶液 |
10.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,3.36L氧气与2.4g碳反应,生成CO2分子数为0.2NA | |
| B. | 标准状况下,1.12LCl2发生反应转移的电子数一定为0.1NA | |
| C. | lL0.lmol•L-1氨水中NH3•H2O分子数为0.1NA | |
| D. | 10g46%酒精(C2H5OH)中含氧原子总数大于0.1NA |