题目内容
6.氧化还原 反应中,元素化合价升高,表示该元素的原子失去电子,含该元素的物质发生氧化反应,这种物质是还原剂;元素化合价降低,表明该元素的原子得到电子,含该元素的物质发生还原反应,这种物质是氧化剂.分析 在氧化后还原反应中,化合价升高元素失电子,被氧化,发生氧化反应,含有该元素的反应物是还原剂,化合价降低元素得到电子,被还原发生还原反应,含有该元素的反应物是氧化剂,以此解答.
解答 解:氧化还原反应,元素化合价升高,表明该元素原子失去电子,含该元素的物质发生氧化反应,这种物质是还原剂;元素化合价降低,表明该元素原子得到电子,含该元素原子的物质发生还原反应,这种物质是氧化剂.
故答案为:失去;氧化;还原;得到;还原;氧化.
点评 本题考查氧化还原反应,为高考高频考点,把握发生的化学反应及化学用语的使用为解答的关键,侧重基础知识和分析应用能力的考查,题目难度不大.

练习册系列答案
相关题目
16.已知c(NH4Cl)≤0.1mol/L时,溶液pH>5.1.现用0.1mol/L盐酸滴定10mL 0.05mol/L氨水,用甲基橙作指示剂,达到滴定终点,所用盐酸的体积为( )
| A. | 10 mL | B. | 5 mL | C. | 大于5 mL | D. | 小于5 mL |
17.铝热法炼铁的化学方程式是:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.这种金属冶炼的方法属于( )
| A. | 热还原法 | B. | 分解法 | C. | 电解法 | D. | 富集法 |
14.一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)?Y(g)+Z(s),不是反应达到平衡标志的是( )
| A. | 混合气体的压强不再变化 | B. | X、Y、Z的物质的量之比为2:1:1 | ||
| C. | 混合气体的密度不再变化 | D. | X的分解速率是Y的分解速率的两倍 |
11.下列有关物质用途的说法中,不正确的是( )
| A. | SO2可用于漂白纸浆 | B. | SiO2是良好的半导体材料 | ||
| C. | Na2O2可用作潜水艇O2来源 | D. | Cl2可用于消毒和制造漂白粉 |
18.已知氯酸钠(NaClO3)与盐酸反应的化学方程式为:NaClO3+6HCl=NaCl+3Cl2↑+3H2O,则氧化产物和还原产物的质量比为( )
| A. | 6:1 | B. | 5:1 | C. | 3:1 | D. | 2:1 |
15.由IIIA 族元素A和VIA 族元素B组成的阴离子结构如下:
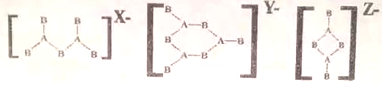
则所带电荷X、Y、Z依次为多少?( )

则所带电荷X、Y、Z依次为多少?( )
| A. | 4、4、2 | B. | 4、3、2 | C. | 3、3、2 | D. | 4、2、2 |
16.下列实验的基本操作中,正确的是( )
| A. | 用同一个滴管取用不同的药品 | |
| B. | 将实验中剩余的药品放回原试剂瓶 | |
| C. | 实验前对实验装置进行气密性检查 | |
| D. | 将实验室制备的可燃性气体直接点燃 |
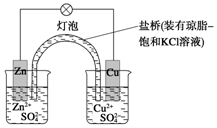 铜锌原电池(如图)工作时
铜锌原电池(如图)工作时