题目内容
11.海水酸化将改变海水化学的种种平衡,使依赖于化学环境稳定性的多种海洋生物乃至生态系统面临巨大威胁.用生石灰中和法阻止海水酸化是人们的一种设想.生石灰属于( )
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
分析 电离时生成的阳离子全部是H+的化合物为酸;
电离时生成的阴离子全部是OH-的化合物为碱;
金属离子或铵根离子(NH4+)与酸根离子或非金属离子结合的化合物为盐;
其构成中只含两种元素,其中一种一定为氧元素,另一种若为金属元素,则为金属氧化物;若为非金属,则为非金属氧化物,据此解答.
解答 解:生石灰化学式为:CaO,有O、Ca两种元素,属于氧化物,
故选:D.
点评 本题考查了物质的分类,熟悉酸、碱、盐、氧化物概念是解题关键,题目难度不大.

练习册系列答案
相关题目
19. 一定条件下,体积为10L的密闭容器中,1molX和1mol Y进行反应:2X(g)+2Y(g)?Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是( )
一定条件下,体积为10L的密闭容器中,1molX和1mol Y进行反应:2X(g)+2Y(g)?Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是( )
 一定条件下,体积为10L的密闭容器中,1molX和1mol Y进行反应:2X(g)+2Y(g)?Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是( )
一定条件下,体积为10L的密闭容器中,1molX和1mol Y进行反应:2X(g)+2Y(g)?Z(g),经60s达到平衡,生成0.3molZ.下列说法正确的是( )| A. | 若升高温度,X的体积分数增大,则正反应的△H>0 | |
| B. | 将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 以X浓度变化表示的反应速率为0.001mol/(L•s) | |
| D. | 若图纵坐标是正反应速率,则反应应该在绝热条件下进行,图象最高点为平衡点 |
16.下列实验的基本操作中,正确的是( )
| A. | 用同一个滴管取用不同的药品 | |
| B. | 将实验中剩余的药品放回原试剂瓶 | |
| C. | 实验前对实验装置进行气密性检查 | |
| D. | 将实验室制备的可燃性气体直接点燃 |
3.设NA为阿伏加德罗常数值.下列说法中正确的是( )
| A. | 122.5 g KClO 3中含Cl-数目为NA | |
| B. | 1 mol/L的NaOH溶液中含Na+数目为NA | |
| C. | 标准状况下,22.4 L水中含氢原子数目为2NA | |
| D. | 常温常压下,32 g S03中含氧原子数目为1.2NA |
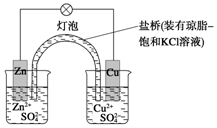 铜锌原电池(如图)工作时
铜锌原电池(如图)工作时 (1)8.4g N2与9.6g某单质Rx所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是16,x值为3.
(1)8.4g N2与9.6g某单质Rx所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是16,x值为3. 的名称2-硝基甲苯(邻硝基甲苯).
的名称2-硝基甲苯(邻硝基甲苯).