题目内容
6.下列说法正确的是( )| 化学式 | 电离常数 |
| CH3COOH | Ka=1.76×10-5 |
| H2SO3 | Ka1=1.54×10-2 |
| Ka2=1.02×10-7 | |
| HF | Ka=6.03×10-4 |
| A. | 在1mol•L-1NaHA(酸式盐)溶液中一定存在:c(Na+)=c(H2A)+c(HA-)+c(A2-) | |
| B. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 已知某温度下常见弱酸的电离平衡常数如上表:相同物质的量浓度的CH3COONa、NaF、Na2SO3、NaHSO3水溶液,溶液中离子总数由小到大排列的顺序是Na2SO3<CH3COONa<NaF<NaHSO3 | |
| D. | pH均等于3的醋酸与盐酸溶液等体积混合后,溶液的pH基本不变 |
分析 A.若H2A为二元强酸,在溶液中不存在H2A分子;
B.根据电荷守恒分析;
C.相同物质的量浓度的CH3COONa、NaF、NaHSO3水溶液,根据电离出的离子数目以及离子的水解程度判断离子总数关系,Na2SO3电离出两个阳离子和一个阴离子,离子数目最多;
D.由于盐酸和醋酸溶液的pH相等,两溶液中氢离子浓度相等,故将两溶液混合后氢离子浓度不变.
解答 解:A.若H2A为二元强酸,NaHA为强酸的酸式盐,溶液中可能不存在H2A,故A错误;
B.根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),溶液为酸性,故氢离子浓度大于氢氧根离子浓度,故c(Na+)<c(CH3COO-),故B错误;
C.相同温度下,酸的强弱酸性是:H2SO3>HF>CH3COOH,酸根离子水解程度大小顺序是:HSO3-<F-<CH3COO-,相同浓度的钠盐溶液中,酸根离子水解程度越大其溶液的离子总数相应变大,所以相同物质的量浓度的CH3COONa、NaF、NaHSO3水溶液,溶液中离子总数由小到大排列的顺序是NaHSO3<NaF<CH3COONa,而Na2SO3电离出两个阳离子和一个阴离子,离子数目最多,所以溶液中离子总数由小到大排列的顺序是NaHSO3<NaF<CH3COONa<Na2SO3,故C错误;
D.常温下,pH均等于3的醋酸与盐酸溶液等体积混合,由于两溶液中氢离子浓度相等,则混合液中氢离子浓度不变,所以混合液的pH仍然为3,故D正确.
故选D.
点评 本题考查了电解质溶液中离子浓度大小比较方法,溶液中电荷守恒的分析判断,溶液中离子的特征性质和水解、电离,是解题关键,题目难度中等,侧重于考查学生的分析应用能力.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
17. 硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
(1)新制的绿矾(FeSO4•7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:4FeSO4•7H2O+O2=4Fe(OH)SO4+26H2O.
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃.
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”.
上述装置Ⅲ和Ⅳ用来检验气体产物.试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在 (选填“0℃、25℃、50℃”),装置Ⅱ的作用是防止产生倒吸.
②装置Ⅲ中的试剂可以是 (选填序号,下同),现象是,则证明气体产物中含有SO3;装置Ⅳ中的试剂可以是B、E.
A.2mol/LNa2CO3溶液 B.品红溶液 C.0.5mol/L BaCl2溶液 D.0.5mol/LBa(NO3)2 E.0.01mol/L KMnO4溶液 F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为SO2+2OH-=SO32-+H2O.
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
⑤若用22.8g FeSO4固体做实验,完全分解后,得到11.2g固体,其中Fe2O3的质量分数=35.7%(精确到0.1%)
 硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.(1)新制的绿矾(FeSO4•7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:4FeSO4•7H2O+O2=4Fe(OH)SO4+26H2O.
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃.
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”.
上述装置Ⅲ和Ⅳ用来检验气体产物.试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在 (选填“0℃、25℃、50℃”),装置Ⅱ的作用是防止产生倒吸.
②装置Ⅲ中的试剂可以是 (选填序号,下同),现象是,则证明气体产物中含有SO3;装置Ⅳ中的试剂可以是B、E.
A.2mol/LNa2CO3溶液 B.品红溶液 C.0.5mol/L BaCl2溶液 D.0.5mol/LBa(NO3)2 E.0.01mol/L KMnO4溶液 F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为SO2+2OH-=SO32-+H2O.
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入KSCN溶液(或硫氰化钾溶液) | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 固体中含有FeO |
14.下列仪器和装置,用橡胶管经过简单连接,可制备收集多种不同的气体(暂不考虑尾气吸收).关于这些装置的连接,下列说法正确的是( )
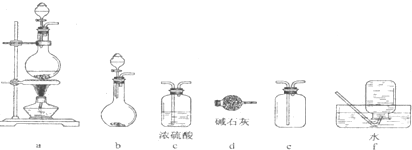

| A. | 加热浓硫酸和乙醇的混合物至170℃制备收集C2H4:连接a→d→f | |
| B. | 制备收集NO2:连接a→c→f | |
| C. | 制备收集Cl2:连接a→d→e | |
| D. | 制备收集NH3:连接b→d→e |
1.下列变化过程中,无化学键断裂或生成的是( )
| A. | 石墨转化为金刚石 | B. | NaCl晶体熔化 | ||
| C. | 干冰升华 | D. | HCl溶于水 |
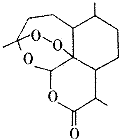 2015年10月5日,中国科学家屠哟坳首次获诺贝尔生理学或医学奖,以表彰她创制新型抗疟药-青蒿素和双氢青蒿素,其中青蒿素的结构简式如图所示,则青蒿素分子中碳、氧原子的个数比为( )
2015年10月5日,中国科学家屠哟坳首次获诺贝尔生理学或医学奖,以表彰她创制新型抗疟药-青蒿素和双氢青蒿素,其中青蒿素的结构简式如图所示,则青蒿素分子中碳、氧原子的个数比为( )